Diferencia entre revisiones de «Firmas espectroscopicas»
Sin resumen de edición |
|||
| (No se muestran 41 ediciones intermedias de 2 usuarios) | |||
| Línea 3: | Línea 3: | ||
El espectro electromagnético cubre longitudes de onda muy variadas. Existen frecuencias de 30 Hz y menores que son relevantes en el estudio de ciertas nebulosas. Se conocen frecuencias cercanas a <math>2.9x10^{27}</math> Hz, que han sido detectadas provenientes de fuentes astrofísicas. | El espectro electromagnético cubre longitudes de onda muy variadas. Existen frecuencias de 30 Hz y menores que son relevantes en el estudio de ciertas nebulosas. Se conocen frecuencias cercanas a <math>2.9x10^{27}</math> Hz, que han sido detectadas provenientes de fuentes astrofísicas. | ||
La energía electromagnética en una particular longitud de onda | La energía electromagnética en una particular longitud de onda <math>{\lambda}</math> (en el vacío) tiene una frecuencia <math>{\nu}</math> asociada y una energía de fotón E. Por tanto, el espectro electromagnético puede ser expresado igualmente en cualquiera de esos términos. Se relacionan en las siguientes ecuaciones: | ||
<math>c={ | <math>c={\lambda}{\nu}</math> o lo que es lo mismo <math>\lambda=\frac{c}{\nu}</math> | ||
<math>E={h}{\nu}</math> | <math>E={h}{\nu}</math> | ||
| Línea 13: | Línea 13: | ||
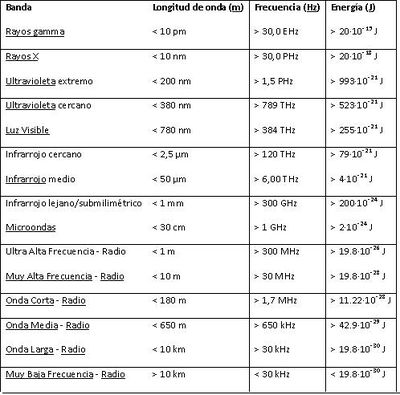
Por lo general, las radiaciones electromagnéticas se clasifican basándose en su longitud de onda en ondas de radio, microondas, infrarrojos, visible que percibimos como luz visible–ultravioleta, rayos X y rayos gamma. En la figura 1, se muestran las longitudes de onda que son utilizadas para cada elemento que queramos visualizar[[Archivo:Dibujo1.JPG|300px|thumb|left|Figura 1: Rangos de longitudes de onda]] | Por lo general, las radiaciones electromagnéticas se clasifican basándose en su longitud de onda en ondas de radio, microondas, infrarrojos, visible que percibimos como luz visible–ultravioleta, rayos X y rayos gamma. En la figura 1, se muestran las longitudes de onda que son utilizadas para cada elemento que queramos visualizar[[Archivo:Dibujo1.JPG|300px|thumb|left|Figura 1: Rangos de longitudes de onda]] | ||
El comportamiento de las radiaciones electromagnéticas depende de su longitud de onda. Cuando la radiación electromagnética interactúa con átomos y moléculas puntuales, su comportamiento también depende de la cantidad de energía por quantum que lleve. Al igual que las ondas de sonido, la radiación electromagnética puede dividirse en octavas. La espectroscopia puede detectar una región mucho más amplia del espectro electromagnético que el rango visible de 400 a 700 nm. Un espectrómetro de laboratorio común y corriente detecta longitudes de onda de 2 a 2500 nm. | El comportamiento de las radiaciones electromagnéticas depende de su longitud de onda. Cuando la radiación electromagnética interactúa con átomos y moléculas puntuales, su comportamiento también depende de la cantidad de energía por quantum que lleve. Al igual que las ondas de sonido, la radiación electromagnética puede dividirse en octavas. La espectroscopia puede detectar una región mucho más amplia del espectro electromagnético que el rango visible de 400 a 700 nm. Un espectrómetro de laboratorio común y corriente detecta longitudes de onda de 2 a 2500 nm. | ||
[[Archivo:Tabla_1.JPG|400px|thumb|left|Tabla 1]] | [[Archivo:Tabla_1.JPG|400px|thumb|left|Tabla 1]] En la tabla 1 podemos visualizar las longitudes de onda para cada rango, ya sea visible, infrarrojo, etc. | ||
== | == Interacción de la radiación con la materia == | ||
Cuando la radiación pasa desde el vacío a la superficie de una porción de | Cuando la radiación pasa desde el vacío a la superficie de una porción de materia, el vector eléctrico de la radiación interacciona con los átomos y moléculas del medio. La interacción depende de la materia y puede dar lugar a la transmisión, absorción o la dispersión de la radiación. | ||
== | == Transmisión de radiación == | ||
Experimentalmente se puede observar que la velocidad con que se propaga la radiación por una sustancia transparente es menor que su velocidad en el vacío; la velocidad dependerá de las clases y concentraciones de átomos, iones o moléculas presentes. Pero no se muestra un cambio de frecuencia. | Experimentalmente se puede observar que la velocidad con que se propaga la radiación por una sustancia transparente es menor que su velocidad en el vacío; la velocidad dependerá de las clases y concentraciones de átomos, iones o moléculas presentes. Pero no se muestra un cambio de frecuencia. | ||
El índice de refracción de un medio es una medida de su interacción con la radiación y se define: | El índice de refracción de un medio es una medida de su interacción con la radiación y se define: | ||
<math>n_{i}=\frac{c}{v_{i}}</math> Donde <math>n_{i}</math> es el índice de refracción en una frecuencia especificada i, <math>v_{i}</math> es la velocidad de la reacción en un medio y c es la velocidad en el vacío. | <math>n_{i}=\frac{c}{v_{i}}</math> Donde <math>n_{i}</math> es el índice de refracción en una frecuencia especificada <math>i</math>, <math>v_{i}</math> es la velocidad de la reacción en un medio y c es la velocidad en el vacío. | ||
=== | === Absorción de radiación === | ||
| Línea 31: | Línea 31: | ||
Para que se produzca absorción de radiación, la energía del fotón excitante debe igualar a la diferencia de energía entre el estado fundamental y uno de los estados excitados de la especie absorbente. Estas diferencias de estados son únicas para cada especie. De esto se obtiene experimentalmente una gráfica de la reducción de potencia radiante (absorbancia) en función de la longitud de onda o frecuencia (la absorbancia una medida de la disminución de la potencia radiante). En la figura 2 se muestra una clase de graficas llamadas espectros de absorción. | Para que se produzca absorción de radiación, la energía del fotón excitante debe igualar a la diferencia de energía entre el estado fundamental y uno de los estados excitados de la especie absorbente. Estas diferencias de estados son únicas para cada especie. De esto se obtiene experimentalmente una gráfica de la reducción de potencia radiante (absorbancia) en función de la longitud de onda o frecuencia (la absorbancia una medida de la disminución de la potencia radiante). En la figura 2 se muestra una clase de graficas llamadas espectros de absorción. | ||
El espectro de absorción caria según el estado físico y el medio ambiente de la especie absorbente. | El espectro de absorción caria según el estado físico y el medio ambiente de la especie absorbente. | ||
[[Archivo: | [[Archivo:Figura 1.JPG|200px|thumb|left|Fifura 2: Espectro de absorcion (250-320 nm)de sodio]] | ||
== Absorbancia == | == Absorbancia == | ||
La absorbancia de una solución está definida por la ecuación | La absorbancia de una solución está definida por la ecuación | ||
<math>A=- | <math>A=-log_{10}</math> | ||
<math>A=-log_{10} T=log{\frac{I_{0}}{I}}</math> | <math>A=-log_{10}{T}=log{\frac{I_{0}}{I}}</math> | ||
A diferencia de la transmitancia, la absorbancia de una solución aumenta a medida que aumenta la atenuación de haz. | A diferencia de la transmitancia, la absorbancia de una solución aumenta a medida que aumenta la atenuación de haz. | ||
| Línea 46: | Línea 46: | ||
<math>A={a}{b}{c}</math> | <math>A={a}{b}{c}</math> | ||
Donde a es una constante de proporcionalidad llamada absortividad. Resulta evidente que la magnitud de a depende de las unidades utilizadas para b y c. cuando se expresa la concentración en moles por litro y la trayectoria a través de la celda en centímetros, la absortividad se denomina absortividad molar y se representa con el símbolo ε. En consecuencia, b se expresa en cm y c en mol por litro, | Donde a es una constante de proporcionalidad llamada absortividad. Resulta evidente que la magnitud de a depende de las unidades utilizadas para b y c. cuando se expresa la concentración en moles por litro y la trayectoria a través de la celda en centímetros, la absortividad se denomina absortividad molar y se representa con el símbolo ε. En consecuencia, b se expresa en cm y c en mol por litro, | ||
<math> | <math>A={\epsilon}{b}{c}</math> | ||
Existen 2 tipos de espectros, los asociados con la absorción atómica y la absorción molecular. | Existen 2 tipos de espectros, los asociados con la absorción atómica y la absorción molecular. | ||
* Absorción atómica: Cunado se pasa radiación policromatica ultravioleta o visible a través de un medio formado por partículas monoatómicas, por ejemplo, | * Absorción atómica: Cunado se pasa radiación policromatica ultravioleta o visible a través de un medio formado por partículas monoatómicas, por ejemplo, espectro de sodio, se produce absorción solo en unas cuantas frecuencias definidas Figura 2. | ||
La radiación ultra violeta y visible tiene suficiente energía para causar transiciones solo de los electrones más externos o electrones de enlace. Por el contrario, las frecuencias de rayos X son varios ordenes de magnitud más energéticas y pueden interaccionar con los electrones más cercanos a los núcleos de los átomos. Por lo que se pueden observar picos de absorción a transiciones electrónicas de los electrones más interiores. Cualquiera que sea la región de longitud de onda, los espectros de absorción atómica tienen un número limitado de picos muy estrechos. | La radiación ultra violeta y visible tiene suficiente energía para causar transiciones solo de los electrones más externos o electrones de enlace. Por el contrario, las frecuencias de rayos X son varios ordenes de magnitud más energéticas y pueden interaccionar con los electrones más cercanos a los núcleos de los átomos. Por lo que se pueden observar picos de absorción a transiciones electrónicas de los electrones más interiores. Cualquiera que sea la región de longitud de onda, los espectros de absorción atómica tienen un número limitado de picos muy estrechos. | ||
| Línea 57: | Línea 57: | ||
<math>E={E_{electronica}}+{E_{vibracional}}+{E_{rotacional}}</math> | <math>E={E_{electronica}}+{E_{vibracional}}+{E_{rotacional}}</math> | ||
Donde E electrónica describe la energía electrónica de la molécula, Evibracional es la energía dela molécula relacionada con las diferentes | Donde E electrónica describe la energía electrónica de la molécula, Evibracional es la energía dela molécula relacionada con las diferentes vibraciones atómicas y E rotacionales la energía asociada con la rotación de la molécula alrededor de un centro de gravedad. | ||
==== Absorción de radiación ==== | ==== Absorción de radiación ==== | ||
Cuando pasa una radiación por una capa transparente de un líquido, solido o gas, pueden eliminarse selectivamente ciertas frecuencias como consecuencia del proceso llamado | Cuando pasa una radiación por una capa transparente de un líquido, solido o gas, pueden eliminarse selectivamente ciertas frecuencias como consecuencia del proceso llamado absorción, en este caso, la energía electromagnética se transfiere a átomos o moléculas que constituyen la muestra; como resultado de ello, estas partículas pasan del estado de más baja energía a estados de mayor energía, o estados excitados. A temperatura ambiente la mayoría de las sustancias se encuentran en su nivel energético más bajo, o sea un estado fundamental. La absorción, producen una transmisión entre el estado fundamental y estados con mayor contenido energético. | ||
Para que se produzca absorción de radiación, la energía del | |||
Para que se produzca absorción de radiación, la energía del fotón excitante debe igualar a la diferencia de energía entre el estado fundamental y uno de los estados excitados de la especie absorbente. Como estas diferencias de energía son únicas para cada especie, un estudio de las frecuencias de radiación absorbida ofrece un medio de caracterizar a los sustituyentes de una muestra de materia. | |||
=== Transmitancia === | === Transmitancia === | ||
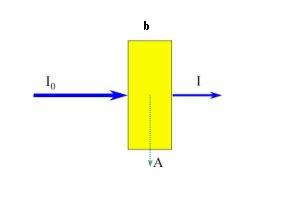
En la figura | En la figura 3 se representa un haz de radiación paralela antes y después de pasar a través de una capa de solución de b cm de espesor, y que contiene una especie molecular que absorbe radiación cuya concentración es c de una especie absorbente. Como consecuencia de las interacciones entre los fotones y las partículas absorbentes, la potencia del haz disminuye de <math>I_{0}</math> a <math>I</math>. la transmitancia <math>T</math> de la solución, es la fracción de radiación incidente transmitida por la solución. | ||
Por lo tanto | |||
Por lo tanto: | |||
<math>T=\frac{I}{I_{0}}</math> | <math>T=\frac{I}{I_{0}}</math> | ||
Que por lo general se expresa como porcentaje. | Que por lo general se expresa como porcentaje. | ||
<math>%T={\frac{I}{I_{0}}} {x100}</math> | <math>%T={\frac{I}{I_{0}}} {x100}</math> | ||
[[Archivo:beer.jpg|300px|thumb|left|Figura 3:Atenuación de un haz de radiación por una solución que absorbe]] | [[Archivo:beer.jpg|300px|thumb|left|Figura 3: Atenuación de un haz de radiación por una solución que absorbe]] | ||
==== Medida de la transmitancia y la absorbancia ==== | ==== Medida de la transmitancia y la absorbancia ==== | ||
| Línea 76: | Línea 80: | ||
Las medidas de transmitancia (o absorbancia) se realizan por medio de instrumentos cuyos componentes se descomponen por medio de una luz (rayos de un foco como fuente) que es espectroscopia de absorción. | Las medidas de transmitancia (o absorbancia) se realizan por medio de instrumentos cuyos componentes se descomponen por medio de una luz (rayos de un foco como fuente) que es espectroscopia de absorción. | ||
La salida eléctrica G del detector del instrumento está dada por: | La salida eléctrica G del detector del instrumento está dada por: | ||
<math>G=KI+ | |||
<math>G=KI+K'</math> | |||
Donde G es la respuesta eléctrica del detector en unidades de corriente, resistencia o fuerza electromotriz (fem). La constante K (constante de proporcionalidad) mide la sensibilidad del detector en términos de respuesta eléctrica por unidad de potencia radiante k´ es la corriente obscura que se observa por lo general cuando no se incide ninguna radiación en el transductor. | Donde G es la respuesta eléctrica del detector en unidades de corriente, resistencia o fuerza electromotriz (fem). La constante K (constante de proporcionalidad) mide la sensibilidad del detector en términos de respuesta eléctrica por unidad de potencia radiante k´ es la corriente obscura que se observa por lo general cuando no se incide ninguna radiación en el transductor. | ||
Para la transmitancia se hace un ajuste eléctrico hasta que la aguja del dispositivo de lectura marque cero; este proceso se denomina ajuste de corriente obscura a T 0%. Para poder realizar el ajuste, es necesario aumentar o disminuir la potencia. | Para la transmitancia se hace un ajuste eléctrico hasta que la aguja del dispositivo de lectura marque cero; este proceso se denomina ajuste de corriente obscura a <math>T</math> 0%. Para poder realizar el ajuste, es necesario aumentar o disminuir la potencia. | ||
Fluorescencia | Fluorescencia | ||
===== Espectroscopia de Fluorescencia molecular ===== | ===== Espectroscopia de Fluorescencia molecular ===== | ||
Es un proceso de emisión en el cual las moléculas son excitadas por la absorción de radiación electromagnética. Las especies se relajan en estado fundamental, liberado un exceso de energía en forma de fotones | Es un proceso de emisión en el cual las moléculas son excitadas por la absorción de radiación electromagnética. Las especies se relajan en estado fundamental, liberado un exceso de energía en forma de fotones | ||
| Línea 89: | Línea 95: | ||
La energía de la radiación fluorescente estará dada por <math>(E_{2}-E_{0})</math>; la radiación emitida tendrá necesariamente una frecuencia menor, o una menor longitud de onda que la radiación que excito la fluorescencia, (este desplazamiento de la longitud de onda hacia las frecuencias menores se denomina desplazamiento de Stokes). La fluorescencia de las moléculas pueda acompañarse de radiación resonante como no resonante. La última tiene a predominar debido a que el número de estados excitados es mucho mayor. | La energía de la radiación fluorescente estará dada por <math>(E_{2}-E_{0})</math>; la radiación emitida tendrá necesariamente una frecuencia menor, o una menor longitud de onda que la radiación que excito la fluorescencia, (este desplazamiento de la longitud de onda hacia las frecuencias menores se denomina desplazamiento de Stokes). La fluorescencia de las moléculas pueda acompañarse de radiación resonante como no resonante. La última tiene a predominar debido a que el número de estados excitados es mucho mayor. | ||
La fluorescencia el proceso luminiscente cesa en forma prácticamente inmediata ( | La fluorescencia el proceso luminiscente cesa en forma prácticamente inmediata (<math><10^{-6}seg</math>), a partir del momento en que se interrumpe la irradiación mientras que la fosforescencia se prolonga durante un periodo fácilmente detectable. | ||
Una de las características más atractivas de la fluorometria es su sensibilidad. Los límites inferiores de este método suelen ser 10 veces menores que los de los métodos de absorción y varían entre pocas milésimas o quizá una centésima de parte por millón | Una de las características más atractivas de la fluorometria es su sensibilidad. Los límites inferiores de este método suelen ser 10 veces menores que los de los métodos de absorción y varían entre pocas milésimas o quizá una centésima de parte por millón | ||
| Línea 97: | Línea 103: | ||
El tipo más sencillo es el que presentan los vapores atómicos diluidos. Los electrones 3s de los átomos de sodio vaporizado pueden ser excitados al estado 3p por la absorción de radiación de 5896 y 5890 Å. Transcurrido un tiempo medio de 10-8 seg, los electrones vuelven al estado fundamental y hacerlo emiten radiación de las mismas dos longitudes de onda, en todas las direcciones este tipo de fluorescencia en que la radiación absorbida se emite de nuevo sin alteración, se conoce como radiación de resonancia o fluorescencia de resonancia. | El tipo más sencillo es el que presentan los vapores atómicos diluidos. Los electrones 3s de los átomos de sodio vaporizado pueden ser excitados al estado 3p por la absorción de radiación de 5896 y 5890 Å. Transcurrido un tiempo medio de 10-8 seg, los electrones vuelven al estado fundamental y hacerlo emiten radiación de las mismas dos longitudes de onda, en todas las direcciones este tipo de fluorescencia en que la radiación absorbida se emite de nuevo sin alteración, se conoce como radiación de resonancia o fluorescencia de resonancia. | ||
Las moléculas o iones poliatomicos también | Las moléculas o iones poliatomicos también presentan radiación de resonancia además es emitida una radiación característica que posee longitud de onda mayor. A este fenómeno se denomina variación de Stokes. | ||
==== Estados excitados ==== | ==== Estados excitados ==== | ||
| Línea 104: | Línea 110: | ||
===== Fosforescencia ===== | ===== Fosforescencia ===== | ||
Después del cruzamiento con sistemas entre un estado excitado de triple, puede hacer mas desviación por conversión interna o externa o por fosforescencia. Una transición triple-singulete es mucho menos probable que una conversión singulete-singulete, y la vida media del estado triple excitado respecto a la emisión varia de 10-4 a varios segundos. Asi pues la emisión procedente de la transición puede persistir cierto tiempo después de terminar la irradiación. | |||
== Espectroscopia de fluorescencia inducida por láser == | == Espectroscopia de fluorescencia inducida por láser == | ||
| Línea 110: | Línea 116: | ||
La espectroscopia óptica tiene diversos métodos para la obtención de espectros, su medida y aplicaciones, en relación con la estructura atómica-molecular de la materia. | La espectroscopia óptica tiene diversos métodos para la obtención de espectros, su medida y aplicaciones, en relación con la estructura atómica-molecular de la materia. | ||
Un espectro depende en principio de la separación entre niveles de energía; que en un sistema molecular puede tener diferentes tipos de energía, por ejemplo energía de rotación, asociada al movimiento de giro o rotación de las moléculas; energía de vibración debido a la oscilación periódicas o vibraciones de los átomos alrededor de sus posiciones de equilibrio; energía electrónica, que depende de las posiciones medidas de los electrones respecto a los núcleos. | Un espectro depende en principio de la separación entre niveles de energía; que en un sistema molecular puede tener diferentes tipos de energía, por ejemplo energía de rotación, asociada al movimiento de giro o rotación de las moléculas; energía de vibración debido a la oscilación periódicas o vibraciones de los átomos alrededor de sus posiciones de equilibrio; energía electrónica, que depende de las posiciones medidas de los electrones respecto a los núcleos. | ||
Un espectro puede definirse como una representación | |||
Un espectro puede definirse como una representación gráfica de la distribución de intensidad de la radiación electromagnética, emisión o absorción por una muestra de sustancia, en función de la longitud de onda (o frecuencia) de radiación. | |||
Los distintos tipos de energía dan lugar a que la emisión o absorción de radiación en distintas zonas de frecuencia. | Los distintos tipos de energía dan lugar a que la emisión o absorción de radiación en distintas zonas de frecuencia. | ||
=== Espectroscopia de fluorescencia láser === | === Espectroscopia de fluorescencia láser === | ||
Algunas características de la radiación | Algunas características de la radiación láser para un instrumento valioso y efectivo en la espectroscopia. | ||
[[Archivo: | |||
[[Archivo:Fuente.JPG|300px|thumb|left|Figura 4: componentes instrumentos de espectroscopia optica]] | |||
La sincronizabilidad de la longitud de onda permite obtener radiación en alguna longitud de onda en el IR visible y UV. La radiación laser puede ser sincronizada (incluyendo los métodos de conversión no lineal de frecuencia) a cualquier longitud de onda sobre un rango desde 0.2 a 20 nm, haciendo posible estudiar cualquier transmisión cuántica de átomos y moléculas. | La sincronizabilidad de la longitud de onda permite obtener radiación en alguna longitud de onda en el IR visible y UV. La radiación laser puede ser sincronizada (incluyendo los métodos de conversión no lineal de frecuencia) a cualquier longitud de onda sobre un rango desde 0.2 a 20 nm, haciendo posible estudiar cualquier transmisión cuántica de átomos y moléculas. | ||
La monocromaticidad de la radiación | |||
La coherencia espacial de la radiación | La monocromaticidad de la radiación láser permite, primero, medidas espectrales con casi cualquier requerimiento de resolución y segundo, excitación selectiva de cierta clase de átomos o moléculas en mezclas. Esta última consideración es particularmente importante para aplicaciones analíticas. | ||
La coherencia espacial de la radiación láser hace posible formar haces de luz altamente colimados para pruebas espectrales de ciertas regiones o para enfocar la radiación sobre ares pequeñas para análisis local. | |||
La espectroscopia fluorescencia es una técnica ampliamente usada en biología y medicina. | La espectroscopia fluorescencia es una técnica ampliamente usada en biología y medicina. | ||
En la figura 4 se muestran los componentes de un instrumento de espectroscopia, como fuente puede ser luz solar, luz artificial o luz de fuego. | |||
==== Variables que afectan a la fluorescencia ==== | ==== Variables que afectan a la fluorescencia ==== | ||
Rendimiento cuántico: es simplemente la relación entre el número de moléculas que emiten fluorescencia respecto al número total de moléculas excitadas. Las moléculas altamente fluorescentes | Rendimiento cuántico: es simplemente la relación entre el número de moléculas que emiten fluorescencia respecto al número total de moléculas excitadas. Las moléculas altamente fluorescentes. | ||
* Estructura: La fluorescencia es más intensa y la más útil es la que presentan los compuestos que contienen estructuras alifáticas y | |||
La sustitución en un anillo aromático causa desplazamientos en la longitud de onda de absorción máxima y los cambios correspondientes en los picos de fluorescencia | * Estructura: La fluorescencia es más intensa y la más útil es la que presentan los compuestos que contienen estructuras alifáticas y ali-cíclicas de carbonilo o estructuras con dobles enlaces muy conjugados. | ||
* Rigidez estructural: empíricamente se encuentra que la | |||
La sustitución en un anillo aromático causa desplazamientos en la longitud de onda de absorción máxima y los cambios correspondientes en los picos de fluorescencia. | |||
* Rigidez estructural: empíricamente se encuentra que la fluorescencia esta favorecida en moléculas que poseen estructuras rígidas. Por ejemplo, las eficacias cuánticas para el fluoreno y el bifenilo están aproximadas a a 1.0 y 0.2, respectivamente, bajo condiciones similares de medida. La influencia de la rigidez también tiene importancia en el aumento de la fluorescencia de ciertos agentes orgánicos cuando están formando un complejo con un ion metálico.[[Archivo:Efecto de la rigidez.JPG|300px|thumb|left|Figura 5]] | |||
* Temperatura y disolvente: la eficacia cuántica de la fluorescencia disminuye en muchas moléculas con el aumento de la temperatura, ya que el aumento de la frecuencia de las colisiones a temperatura elevada hace aumentar la probabilidad de desactivación no radiante(conversión externa). Una disminución en la viscosidad del disolvente también aumenta la probabilidad de conversión externa y produce el mismo resultado. | * Temperatura y disolvente: la eficacia cuántica de la fluorescencia disminuye en muchas moléculas con el aumento de la temperatura, ya que el aumento de la frecuencia de las colisiones a temperatura elevada hace aumentar la probabilidad de desactivación no radiante(conversión externa). Una disminución en la viscosidad del disolvente también aumenta la probabilidad de conversión externa y produce el mismo resultado. | ||
* El efecto den pH: La fluorescencia de un compuesto aromático con sustituyentes ácidos o básicos en el anillo depende normalmente del pH. Tanto la longitud de onda como la intensidad de emisión son probablemente diferentes para la forma ionizada y no ionizada del compuesto. Por lo tanto será muy frecuente en los métodos fluorimetros el control del pH. | * El efecto den pH: La fluorescencia de un compuesto aromático con sustituyentes ácidos o básicos en el anillo depende normalmente del pH. Tanto la longitud de onda como la intensidad de emisión son probablemente diferentes para la forma ionizada y no ionizada del compuesto. Por lo tanto será muy frecuente en los métodos fluorimetros el control del pH. | ||
* Efectos de concentración en la intensidad de fluorescencia: La potencia de radiación fluorescente F es proporcional a la potencia radiante del haz de excitación que es absorbido por el sistema. | * Efectos de concentración en la intensidad de fluorescencia: La potencia de radiación fluorescente F es proporcional a la potencia radiante del haz de excitación que es absorbido por el sistema. | ||
<math>F= | |||
<math>F=K'(P_{0}-P)</math> | |||
Donde <math>P_{0}</math> es la potencia del haz incidente sobre la disolución y P es su potencia después de atravesar la longitud b del medio. La constante K´ depende de la eficacia cuántica del proceso de fluorescencia. Con objeto de relacionar F con la concentración c escribimos la ley de Beer así: | Donde <math>P_{0}</math> es la potencia del haz incidente sobre la disolución y P es su potencia después de atravesar la longitud b del medio. La constante K´ depende de la eficacia cuántica del proceso de fluorescencia. Con objeto de relacionar F con la concentración c escribimos la ley de Beer así: | ||
| Línea 136: | Línea 158: | ||
Sustituyendo nos queda: <math>F=k^{ | Sustituyendo nos queda: <math>F=k^{'}{P_{0}}(1-10^{-\epsilon} {b}{c})</math> | ||
== Análisis de la fluorescencia == | == Análisis de la fluorescencia == | ||
Los distintos componentes de los fluorometros son semejantes a los que existen en los fotómetros o espectro fotómetros de ultravioleta y visible. La figura 6 muestra la configuración caracteristica de los componentes de un fluorometro o un espectrofluorometro. Se utiliza óptica para las variaciones de la fuente | Los distintos componentes de los fluorometros son semejantes a los que existen en los fotómetros o espectro fotómetros de ultravioleta y visible. La figura 6 muestra la configuración caracteristica de los componentes de un fluorometro o un espectrofluorometro. Se utiliza óptica para las variaciones de la fuente. | ||
[[Archivo: | |||
[[Archivo:Fluorometro-de-filtro-349951.jpg|300px|thumb|left|Figura 6: Componentes de un fluorometro o espectro fluorometro]] | |||
El haz de la muestra pasa primero a través de un filtro de excitación o un monocromador que sirve para trasmitir aquella parte del has que excitara la fluorescencia, excluyendo las longitudes de onda que se producirán posteriormente de la muestra irradiada. La muestra emite radiación fluorescente en todas direcciones pero se observa mejor perpendicularmente a las de excitación. | El haz de la muestra pasa primero a través de un filtro de excitación o un monocromador que sirve para trasmitir aquella parte del has que excitara la fluorescencia, excluyendo las longitudes de onda que se producirán posteriormente de la muestra irradiada. La muestra emite radiación fluorescente en todas direcciones pero se observa mejor perpendicularmente a las de excitación. | ||
En la figura 6 se muestra un fluorometro este se utiliza para la detección de espectros fluorescentes, este instrumento se compone de una fuente de luz, que pasa por un filtro de excitación o monocromador pasa por la muestra, ingresa a un filtro de emisión o monocromador, y apara finalizar por un amplificador diferencial, el cual se reflejara en un dispositivo de lectura. | |||
== Espectroscopia de la radiación infrarroja == | == Espectroscopia de la radiación infrarroja == | ||
Esta espectroscopia se fundamenta en la absorción de | Esta espectroscopia se fundamenta en la absorción de las moléculas en vibración. Una molécula absorberá la energía de un haz de luz infrarroja cuando dicha energía incidente sea igual a la necesaria para que sea una transición vibracional de la molécula. Es decir, la molécula comienza a vibrar de una determinada manera gracias a la energía que se le suministra mediante luz infrarroja. | ||
Pueden distinguirse dos categorías básicas de vibraciones: | Pueden distinguirse dos categorías básicas de vibraciones: De tensión y de flexión. Las vibraciones de tensión son cambios en la distancia interatómica a lo largo del eje del enlace entre dos átomos. Las vibraciones de flexión están originadas por cambios en el ángulo que forman dos enlaces. En la figura 7 se representan los diferentes tipos de vibraciones moleculares. | ||
[[Archivo:Imagen2.JPG|300px|thumb|left|Figura 7: Tipos de vibraciones moleculares]] | [[Archivo:Imagen2.JPG|300px|thumb|left|Figura 7: Tipos de vibraciones moleculares]] | ||
| Línea 156: | Línea 182: | ||
En la zona del espectro electromagnético IR con longitudes de onda del infrarrojo medio (entre 4000 y 1300 <math>cm^{-1}</math>) se suelen observar una serie de bandas de absorción provocadas por las vibraciones entre únicamente dos átomos de la molécula. Estas vibraciones derivan de grupos que contienen hidrógeno o de grupos con dobles o triples enlaces aislados. | En la zona del espectro electromagnético IR con longitudes de onda del infrarrojo medio (entre 4000 y 1300 <math>cm^{-1}</math>) se suelen observar una serie de bandas de absorción provocadas por las vibraciones entre únicamente dos átomos de la molécula. Estas vibraciones derivan de grupos que contienen hidrógeno o de grupos con dobles o triples enlaces aislados. | ||
En la zona del espectro electromagnético IR con longitudes de onda comprendidas entre 1300 y 400 <math>cm^{-1}</math> (infrarrojo lejano), la asignación de las bandas de absorción a vibraciones moleculares es más difícil de realizar, debido a que cada una de ellas está generada por absorciones individuales sumadas (multiplicidad de las bandas). Es la denominada zona de la huella dactilar (flexión de enlaces CH, CO, CN, CC, etc..). En esta zona de longitudes de onda, pequeñas diferencias en la estructura y constitución de las moléculas dan lugar a variaciones importantes en los máximos de absorción. | En la zona del espectro electromagnético IR con longitudes de onda comprendidas entre 1300 y 400 <math>cm^{-1}</math> (infrarrojo lejano), la asignación de las bandas de absorción a vibraciones moleculares es más difícil de realizar, debido a que cada una de ellas está generada por absorciones individuales sumadas (multiplicidad de las bandas). Es la denominada zona de la huella dactilar (flexión de enlaces CH, CO, CN, CC, etc..). En esta zona de longitudes de onda, pequeñas diferencias en la estructura y constitución de las moléculas dan lugar a variaciones importantes en los máximos de absorción. | ||
El espectro de infrarrojo del compuesto 1,3 | |||
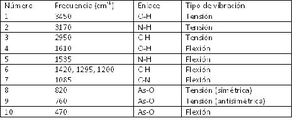
El espectro de infrarrojo del compuesto 1,3 diaminopropano se representa a continuación. En él se observan una serie de bandas de absorción (mínimos de transmisión o transmitancia) que se encuentran numerados del 1 al 10. Comparando la posición de las bandas de absorción observadas en el espectro con la tabla de bandas esperadas, se puede realizar la asignación y comprobar los grupos moleculares presentes en nuestro compuesto:[[Archivo:Tabla 2.JPG|300px|thumb|left|Tabla 2]]En la tabla 2 se indican algunos tipos de enlace la frecuencia en en espectro y el tipo de vibracion para empezar a leer los espectros. | |||
Comparando la posición de las bandas de absorción observadas en el espectro con la tabla de bandas esperadas, se puede realizar la asignación y comprobar los grupos moleculares presentes en nuestro compuesto:[[Archivo:Tabla 2.JPG|300px|thumb|left]] | |||
[[Archivo: | En la figura 8 podemos empezar a inteficar los dipolos de enlace, y la la presencia de átomos en el espectro ayudándonos de la tabla 2. | ||
[[Archivo:IRnumerado.JPG|300px|thumb|left|Figura 8]] | |||
=== Detección de moléculas === | === Detección de moléculas === | ||
* Disolventes. Al escoger un disolvente debe considerarse no solo su transparencia sino también sus efectos en el sistema absorbente. Los disolventes polares como agua alcoholes esteres y cetonas tienen a obliterar la estructura espectral fina producida por los efectos vibratorios; los espectros se acercan más a los de la fase gaseosa | * Disolventes. Al escoger un disolvente debe considerarse no solo su transparencia sino también sus efectos en el sistema absorbente. Los disolventes polares como agua alcoholes esteres y cetonas tienen a obliterar la estructura espectral fina producida por los efectos vibratorios; los espectros se acercan más a los de la fase gaseosa se observa más en disolventes no polares como los hidrocarburos. | ||
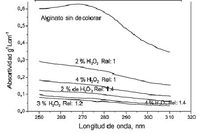
Es importante emplear disolventes idénticos cuando se comparan espectros de absorción para fines de identificación. | Es importante emplear disolventes idénticos cuando se comparan espectros de absorción para fines de identificación.[[Archivo:Efecto de dicolvemte.JPG|300px|thumb|left|Figura 9: espectro de ciclamato]] | ||
En la tabla | |||
En la figura 9 en cual da un método rápido y simple que emplea fase reversa, combinada con fotometría indirecta visible (433nm). Para la determinación se emplea rojo de metilo, un colorante cromogénico que tiene un gran espectro de absorción UV/luz visible, con un pico máximo de absorción a los 433 nm, que fue usado para la separación cromatográfica. | |||
En la tabla 3 aparecen algunos disolventes y la longitud de onda aproximada debajo de la cual no pueden usarse a la absorción. Estos mínimos dependen de la pureza del disolvente. | |||
[[Archivo:Tabla4.jpg|300px|thumb|left|Tabla 4]] | [[Archivo:Tabla4.jpg|300px|thumb|left|Tabla 4]] | ||
== | == Métodos para la representación gráfica del espectro == | ||
En la figura 10 se muestran espectros de absorción de soluciones de hidróxido de potasio, graficados con 2 tipos de ordenada. | |||
En la | |||
La diferenciación de los gráficos de absorbancia es mayor a bajos valores de transmitrancia o elevados valores de absorbancia. | La diferenciación de los gráficos de absorbancia es mayor a bajos valores de transmitrancia o elevados valores de absorbancia. | ||
Los gráficos que se basan en el logaritmo de la absorbancia como se muestra en la figura 7c, resultan convenientes para la comparación de espectros. Si se escribe la ley de Beer: <math>logA=log\epsilon+log{b}{c}</math> | Los gráficos que se basan en el logaritmo de la absorbancia como se muestra en la figura 7c, resultan convenientes para la comparación de espectros. Si se escribe la ley de Beer: <math>logA=log\epsilon+log{b}{c}</math> | ||
Se observa que de todos los términos del lado derecho de la ecuación, solo ε varia con la longitud de onda. Cuando se comparan las gráficas de logA con las de A | Se observa que de todos los términos del lado derecho de la ecuación, solo ε varia con la longitud de onda. Cuando se comparan las gráficas de logA con las de A, resulta evidente la ventaja de las primeras para los estudios de tipo cualitativo. Observece también por el mismo motivo, las gráficas de los ε, resulta también fácilmente comparable. | ||
=== Detección de grupos funcionales === | |||
== | |||
Una débil banda de absorción de la región de 280 a 290 nm que se | Una débil banda de absorción de la región de 280 a 290 nm que se desplaza hacia longitudes de ondas mas cortas con el aumento de la polaridad del disolvente es una fuerte indicación de la presencia del grupo carbonilo. Una débil banda de absorción de 260nm con indicaciones de la estructura fina vibratoria constituye de una prueba de la presencia de un anillo aromático la confirmación de la presencia de una amina aromática o una estructura feolica puede obtenerse comparando los efectos del pH sobre los espectros de las soluciones que contienen la muestra con los mostrados en la tabla 4 para el fenol y la anilina. | ||
[[Archivo:Tabla 6.jpg|300px|thumb|left|Tabla | |||
Aunque pueden ocurrir que no proporcionen la clara identificación de un compuesto orgánico, las mediciones de absorción en las regiones visible y ultra violeta son útiles para descubrir la presencia de ciertos grupos funcionales que actúan como cromoferos. <ref> Skoog Douglas A., ''Principios de análisis instrumental'', Cengage Learning Editores, quinta edición </ref> En la tabla 5 se muestra las bandas de absorción para cada compuesto orgánico. | |||
[[Archivo:Tabla 6.jpg|300px|thumb|left|Tabla 5: Características de absorción de compuestos aromáticos]] | |||
== Análisis cuantitativo por mediciones de absorción == | == Análisis cuantitativo por mediciones de absorción == | ||
La espectroscopia de absorción es uno de los instrumentos mas | La espectroscopia de absorción es uno de los instrumentos mas útiles en que se dispone para análisis cuantitativo. Las características mas importantes de los métodos espectrofotométricos y fotométricos: | ||
* Gran aplicación. Una variedad de especies inorgánica y | |||
* Alta sensibilidad. Las absortividades molares de 10000 a 40000 son comunes, particularmente para los complejos de transferencia de las especies inorgánicas en consecuencia es posible el análisis para concentraciones dentro del intervalo de 10-4 a 10-5 M. | * Gran aplicación. Una variedad de especies inorgánica y orgánicas absorben las longitudes de onda de la región ultravioleta y visible, y por ello son susceptibles de cuantificación. Muchas especies no son absorbentes pueden analizarse después de ser convertida en especies absorbentes mediante un tratamiento químico apropiado. | ||
* Alta sensibilidad. Las absortividades molares de 10000 a 40000 son comunes, particularmente para los complejos de transferencia de las especies inorgánicas en consecuencia es posible el análisis para concentraciones dentro del intervalo de <math>10^{-4}</math> a <math>10^{-5}</math> M. | |||
* Selectividad de moderada a alta. Puede ser posible encontrar una región de longitud de onda en la que el único componente absorbente de una muestra sea la sustancia que se determina. Cuando existe una superposición parcial de las bandas de absorción, a menudo son posibles las correcciones basadas en más mediciones a otras longitudes de onda. Por lo que puede omitirse el paso de la separación. | * Selectividad de moderada a alta. Puede ser posible encontrar una región de longitud de onda en la que el único componente absorbente de una muestra sea la sustancia que se determina. Cuando existe una superposición parcial de las bandas de absorción, a menudo son posibles las correcciones basadas en más mediciones a otras longitudes de onda. Por lo que puede omitirse el paso de la separación. | ||
* Buena precisión. El error relativo en las mediciones de concentración se encuentra entre los límites de uno a 3% estos errores pueden ser reducidos a unas pocas décimas de porcentaje por medio de unas precauciones especiales | |||
* Buena precisión. El error relativo en las mediciones de concentración se encuentra entre los límites de uno a 3% estos errores pueden ser reducidos a unas pocas décimas de porcentaje por medio de unas precauciones especiales. | |||
* Facilidad y comodidad. Se realizan mediciones espectro fotométricas y fotométricas con facilidad y rapidez, usando otro tipo de instrumento. | * Facilidad y comodidad. Se realizan mediciones espectro fotométricas y fotométricas con facilidad y rapidez, usando otro tipo de instrumento. | ||
=== Espectroscopia atómica === | === Espectroscopia atómica === | ||
| Línea 202: | Línea 241: | ||
===== Tipos de espectroscopia de llama ===== | ===== Tipos de espectroscopia de llama ===== | ||
* Emisión atómica o emisión de llama: se basa en la medida de la potencia radiante de una línea emitida por la sustancia aspirada dentro de una llama caliente. | * Emisión atómica o emisión de llama: se basa en la medida de la potencia radiante de una línea emitida por la sustancia aspirada dentro de una llama caliente.Para separar dicha línea de la radiación producida por la llama así como por los demás constituyentes de la muestra, se emplea un filtro. | ||
Para separar dicha línea de la radiación producida por la llama | |||
* Absorción de llama o absorción atómica: la llama cumple con la misma función que la celda es un espectrofotómetro o fotómetro, se puede considerar que la llama esta constituida por una solución gaseosa diluida en una muestra atomizada en un sitio por medio del dispositivo aspirador y quemador. | * Absorción de llama o absorción atómica: la llama cumple con la misma función que la celda es un espectrofotómetro o fotómetro, se puede considerar que la llama esta constituida por una solución gaseosa diluida en una muestra atomizada en un sitio por medio del dispositivo aspirador y quemador. | ||
* Fluorescencia atómica o fluorescencia de llama. La llama también sirve para formar las partículas | |||
* Fluorescencia atómica o fluorescencia de llama. La llama también sirve para formar las partículas atómicas y mantenerlas en un trayecto luminoso por su excitación por una fuente adecuada (fotómetro). | |||
== Espectros de Emisión Atómica == | == Espectros de Emisión Atómica == | ||
| Línea 219: | Línea 259: | ||
En una llama, los átomos pueden presentar fluorescencia cuando se irradia con una fuente intensa que contiene las longitudes de onda que se absorben por el elemento. La radiación que se observa es , por lo general el resultado de la fluorescencia de resonancia. | En una llama, los átomos pueden presentar fluorescencia cuando se irradia con una fuente intensa que contiene las longitudes de onda que se absorben por el elemento. La radiación que se observa es , por lo general el resultado de la fluorescencia de resonancia. | ||
Espectros moleculares en llama | === Espectros moleculares en llama === | ||
El hidrógeno o los hidrocarburos utilizados como combustibles producen bandas de absorción y emisión en ciertos intervalos de longitud de onda por la presencia de radicales OH y CN y las moléculas <math>C_{2}</math> . Algunos metales alcalino-térreos o de las tierras raras forman también hidróxidos que absorben y emiten a través de una amplia gama de longitudes de onda. | |||
En la figura se muestra un ejemplo que corresponde al espectro de emisión y absorción del CaOH. En la cual la línea interrumpida muestra la longitud de onda de la línea de resonancia del bario. | En la figura se muestra un ejemplo que corresponde al espectro de emisión y absorción del CaOH. En la cual la línea interrumpida muestra la longitud de onda de la línea de resonancia del bario. | ||
La interferencia del calcio en el análisis del bario por absorción atómica puede evitarse si se emplea una llama caliente que descompone la molécula de CaOH, y hace desaparecer la banda de absorción molecular. | La interferencia del calcio en el análisis del bario por absorción atómica puede evitarse si se emplea una llama caliente que descompone la molécula de CaOH, y hace desaparecer la banda de absorción molecular. | ||
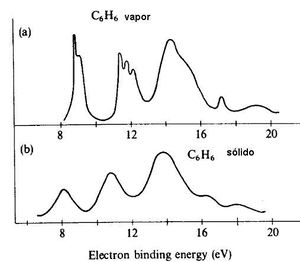
en la figura 10 se muestran espectros de una sustancia solida y liquida, en esta observamos que en los sólidos los espectros son mas angostos y con una cresta mas fina y en los sólidos pasa lo contrario. | |||
[[Archivo:Espec 4.jpg|300px|thumb|left|Figura 10]] | |||
[[Category:optica]] | |||
[[category:investigacion]] | |||
Revisión actual - 06:56 6 oct 2023
Rango energético del espectro
El espectro electromagnético cubre longitudes de onda muy variadas. Existen frecuencias de 30 Hz y menores que son relevantes en el estudio de ciertas nebulosas. Se conocen frecuencias cercanas a Hz, que han sido detectadas provenientes de fuentes astrofísicas. La energía electromagnética en una particular longitud de onda (en el vacío) tiene una frecuencia asociada y una energía de fotón E. Por tanto, el espectro electromagnético puede ser expresado igualmente en cualquiera de esos términos. Se relacionan en las siguientes ecuaciones: o lo que es lo mismo
Sustituyendo :
Donde (velocidad de la luz) y (constante de Planck) Por lo tanto, las ondas electromagnéticas de alta frecuencia tienen una longitud de onda corta y mucha energía mientras que las ondas de baja frecuencia tienen grandes longitudes de onda y poca energía.
Por lo general, las radiaciones electromagnéticas se clasifican basándose en su longitud de onda en ondas de radio, microondas, infrarrojos, visible que percibimos como luz visible–ultravioleta, rayos X y rayos gamma. En la figura 1, se muestran las longitudes de onda que son utilizadas para cada elemento que queramos visualizar
El comportamiento de las radiaciones electromagnéticas depende de su longitud de onda. Cuando la radiación electromagnética interactúa con átomos y moléculas puntuales, su comportamiento también depende de la cantidad de energía por quantum que lleve. Al igual que las ondas de sonido, la radiación electromagnética puede dividirse en octavas. La espectroscopia puede detectar una región mucho más amplia del espectro electromagnético que el rango visible de 400 a 700 nm. Un espectrómetro de laboratorio común y corriente detecta longitudes de onda de 2 a 2500 nm.
En la tabla 1 podemos visualizar las longitudes de onda para cada rango, ya sea visible, infrarrojo, etc.
Interacción de la radiación con la materia
Cuando la radiación pasa desde el vacío a la superficie de una porción de materia, el vector eléctrico de la radiación interacciona con los átomos y moléculas del medio. La interacción depende de la materia y puede dar lugar a la transmisión, absorción o la dispersión de la radiación.
Transmisión de radiación
Experimentalmente se puede observar que la velocidad con que se propaga la radiación por una sustancia transparente es menor que su velocidad en el vacío; la velocidad dependerá de las clases y concentraciones de átomos, iones o moléculas presentes. Pero no se muestra un cambio de frecuencia. El índice de refracción de un medio es una medida de su interacción con la radiación y se define: Donde es el índice de refracción en una frecuencia especificada , es la velocidad de la reacción en un medio y c es la velocidad en el vacío.
Absorción de radiación
Cuando pasa una radiación por una capa transparente de un sólido, líquido o gas, pueden eliminarse selectivamente ciertas frecuencias como consecuencia del proceso llamado absorción. En este caso, la energía electromagnética se transfiere a los átomos o moléculas que constituye la muestra; como resultado de ello, estas partículas pasan del estado de más baja energía a estados de mayor energía, o excitados. Para que se produzca absorción de radiación, la energía del fotón excitante debe igualar a la diferencia de energía entre el estado fundamental y uno de los estados excitados de la especie absorbente. Estas diferencias de estados son únicas para cada especie. De esto se obtiene experimentalmente una gráfica de la reducción de potencia radiante (absorbancia) en función de la longitud de onda o frecuencia (la absorbancia una medida de la disminución de la potencia radiante). En la figura 2 se muestra una clase de graficas llamadas espectros de absorción. El espectro de absorción caria según el estado físico y el medio ambiente de la especie absorbente.
Absorbancia
La absorbancia de una solución está definida por la ecuación A diferencia de la transmitancia, la absorbancia de una solución aumenta a medida que aumenta la atenuación de haz.
Absortividad y Absortividad molar
La absorbancia es directamente proporcional a la trayectoria de la radiación a través de la solución y a la concentración de la especie que produce la absorción. Es decir, A=abc Donde a es una constante de proporcionalidad llamada absortividad. Resulta evidente que la magnitud de a depende de las unidades utilizadas para b y c. cuando se expresa la concentración en moles por litro y la trayectoria a través de la celda en centímetros, la absortividad se denomina absortividad molar y se representa con el símbolo ε. En consecuencia, b se expresa en cm y c en mol por litro,
Existen 2 tipos de espectros, los asociados con la absorción atómica y la absorción molecular.
- Absorción atómica: Cunado se pasa radiación policromatica ultravioleta o visible a través de un medio formado por partículas monoatómicas, por ejemplo, espectro de sodio, se produce absorción solo en unas cuantas frecuencias definidas Figura 2.
La radiación ultra violeta y visible tiene suficiente energía para causar transiciones solo de los electrones más externos o electrones de enlace. Por el contrario, las frecuencias de rayos X son varios ordenes de magnitud más energéticas y pueden interaccionar con los electrones más cercanos a los núcleos de los átomos. Por lo que se pueden observar picos de absorción a transiciones electrónicas de los electrones más interiores. Cualquiera que sea la región de longitud de onda, los espectros de absorción atómica tienen un número limitado de picos muy estrechos.
- Absorción molecular: La absorción por moléculas poliatomicas, en estado condensado, es un proceso considerablemente más complejo porque el número de estados de energía está muy aumentado. La energía total de la molécula está dada por:
Donde E electrónica describe la energía electrónica de la molécula, Evibracional es la energía dela molécula relacionada con las diferentes vibraciones atómicas y E rotacionales la energía asociada con la rotación de la molécula alrededor de un centro de gravedad.
Absorción de radiación
Cuando pasa una radiación por una capa transparente de un líquido, solido o gas, pueden eliminarse selectivamente ciertas frecuencias como consecuencia del proceso llamado absorción, en este caso, la energía electromagnética se transfiere a átomos o moléculas que constituyen la muestra; como resultado de ello, estas partículas pasan del estado de más baja energía a estados de mayor energía, o estados excitados. A temperatura ambiente la mayoría de las sustancias se encuentran en su nivel energético más bajo, o sea un estado fundamental. La absorción, producen una transmisión entre el estado fundamental y estados con mayor contenido energético.
Para que se produzca absorción de radiación, la energía del fotón excitante debe igualar a la diferencia de energía entre el estado fundamental y uno de los estados excitados de la especie absorbente. Como estas diferencias de energía son únicas para cada especie, un estudio de las frecuencias de radiación absorbida ofrece un medio de caracterizar a los sustituyentes de una muestra de materia.
Transmitancia
En la figura 3 se representa un haz de radiación paralela antes y después de pasar a través de una capa de solución de b cm de espesor, y que contiene una especie molecular que absorbe radiación cuya concentración es c de una especie absorbente. Como consecuencia de las interacciones entre los fotones y las partículas absorbentes, la potencia del haz disminuye de a . la transmitancia de la solución, es la fracción de radiación incidente transmitida por la solución.
Por lo tanto:
Que por lo general se expresa como porcentaje.
Medida de la transmitancia y la absorbancia
Las medidas de transmitancia (o absorbancia) se realizan por medio de instrumentos cuyos componentes se descomponen por medio de una luz (rayos de un foco como fuente) que es espectroscopia de absorción. La salida eléctrica G del detector del instrumento está dada por:
Donde G es la respuesta eléctrica del detector en unidades de corriente, resistencia o fuerza electromotriz (fem). La constante K (constante de proporcionalidad) mide la sensibilidad del detector en términos de respuesta eléctrica por unidad de potencia radiante k´ es la corriente obscura que se observa por lo general cuando no se incide ninguna radiación en el transductor. Para la transmitancia se hace un ajuste eléctrico hasta que la aguja del dispositivo de lectura marque cero; este proceso se denomina ajuste de corriente obscura a 0%. Para poder realizar el ajuste, es necesario aumentar o disminuir la potencia. Fluorescencia
Espectroscopia de Fluorescencia molecular
Es un proceso de emisión en el cual las moléculas son excitadas por la absorción de radiación electromagnética. Las especies se relajan en estado fundamental, liberado un exceso de energía en forma de fotones
La fluorescencia de resonancia es producida por los átomos en estado gaseoso que no poseen estados energéticos vibratorios súper puestos en los estados energéticos electrónicos. La absorción de radiación promueve las moléculas a alguno de los diferentes niveles vibratorios relacionados con los dos niveles electrónicos excitados. Los tiempos de duración de los dos estados vibratorios excitados son instantáneos . No siempre la energía de radiación absorbida es mayor que la radiación emitida.
La energía de la radiación fluorescente estará dada por ; la radiación emitida tendrá necesariamente una frecuencia menor, o una menor longitud de onda que la radiación que excito la fluorescencia, (este desplazamiento de la longitud de onda hacia las frecuencias menores se denomina desplazamiento de Stokes). La fluorescencia de las moléculas pueda acompañarse de radiación resonante como no resonante. La última tiene a predominar debido a que el número de estados excitados es mucho mayor.
La fluorescencia el proceso luminiscente cesa en forma prácticamente inmediata (), a partir del momento en que se interrumpe la irradiación mientras que la fosforescencia se prolonga durante un periodo fácilmente detectable.
Una de las características más atractivas de la fluorometria es su sensibilidad. Los límites inferiores de este método suelen ser 10 veces menores que los de los métodos de absorción y varían entre pocas milésimas o quizá una centésima de parte por millón
Teoría de fluorescencias
El tipo más sencillo es el que presentan los vapores atómicos diluidos. Los electrones 3s de los átomos de sodio vaporizado pueden ser excitados al estado 3p por la absorción de radiación de 5896 y 5890 Å. Transcurrido un tiempo medio de 10-8 seg, los electrones vuelven al estado fundamental y hacerlo emiten radiación de las mismas dos longitudes de onda, en todas las direcciones este tipo de fluorescencia en que la radiación absorbida se emite de nuevo sin alteración, se conoce como radiación de resonancia o fluorescencia de resonancia.
Las moléculas o iones poliatomicos también presentan radiación de resonancia además es emitida una radiación característica que posee longitud de onda mayor. A este fenómeno se denomina variación de Stokes.
Estados excitados
Recordar que el enlace entre dos átomos consiste en uno o más orbitales moleculares formados por la superposición parcial de los orbitales atómicos del par de electrones que forman el enlace. La combinación de los orbitales atómicos origina un orbital de enlace y un orbital de antienlace; el primero tiene la energía más baja y es ocupado por los electrones del estado fundamental.
Fosforescencia
Después del cruzamiento con sistemas entre un estado excitado de triple, puede hacer mas desviación por conversión interna o externa o por fosforescencia. Una transición triple-singulete es mucho menos probable que una conversión singulete-singulete, y la vida media del estado triple excitado respecto a la emisión varia de 10-4 a varios segundos. Asi pues la emisión procedente de la transición puede persistir cierto tiempo después de terminar la irradiación.
Espectroscopia de fluorescencia inducida por láser
La espectroscopia óptica tiene diversos métodos para la obtención de espectros, su medida y aplicaciones, en relación con la estructura atómica-molecular de la materia. Un espectro depende en principio de la separación entre niveles de energía; que en un sistema molecular puede tener diferentes tipos de energía, por ejemplo energía de rotación, asociada al movimiento de giro o rotación de las moléculas; energía de vibración debido a la oscilación periódicas o vibraciones de los átomos alrededor de sus posiciones de equilibrio; energía electrónica, que depende de las posiciones medidas de los electrones respecto a los núcleos.
Un espectro puede definirse como una representación gráfica de la distribución de intensidad de la radiación electromagnética, emisión o absorción por una muestra de sustancia, en función de la longitud de onda (o frecuencia) de radiación. Los distintos tipos de energía dan lugar a que la emisión o absorción de radiación en distintas zonas de frecuencia.
Espectroscopia de fluorescencia láser
Algunas características de la radiación láser para un instrumento valioso y efectivo en la espectroscopia.
La sincronizabilidad de la longitud de onda permite obtener radiación en alguna longitud de onda en el IR visible y UV. La radiación laser puede ser sincronizada (incluyendo los métodos de conversión no lineal de frecuencia) a cualquier longitud de onda sobre un rango desde 0.2 a 20 nm, haciendo posible estudiar cualquier transmisión cuántica de átomos y moléculas.
La monocromaticidad de la radiación láser permite, primero, medidas espectrales con casi cualquier requerimiento de resolución y segundo, excitación selectiva de cierta clase de átomos o moléculas en mezclas. Esta última consideración es particularmente importante para aplicaciones analíticas.
La coherencia espacial de la radiación láser hace posible formar haces de luz altamente colimados para pruebas espectrales de ciertas regiones o para enfocar la radiación sobre ares pequeñas para análisis local.
La espectroscopia fluorescencia es una técnica ampliamente usada en biología y medicina.
En la figura 4 se muestran los componentes de un instrumento de espectroscopia, como fuente puede ser luz solar, luz artificial o luz de fuego.
Variables que afectan a la fluorescencia
Rendimiento cuántico: es simplemente la relación entre el número de moléculas que emiten fluorescencia respecto al número total de moléculas excitadas. Las moléculas altamente fluorescentes.
- Estructura: La fluorescencia es más intensa y la más útil es la que presentan los compuestos que contienen estructuras alifáticas y ali-cíclicas de carbonilo o estructuras con dobles enlaces muy conjugados.
La sustitución en un anillo aromático causa desplazamientos en la longitud de onda de absorción máxima y los cambios correspondientes en los picos de fluorescencia.
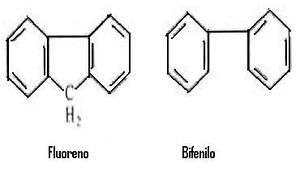
- Rigidez estructural: empíricamente se encuentra que la fluorescencia esta favorecida en moléculas que poseen estructuras rígidas. Por ejemplo, las eficacias cuánticas para el fluoreno y el bifenilo están aproximadas a a 1.0 y 0.2, respectivamente, bajo condiciones similares de medida. La influencia de la rigidez también tiene importancia en el aumento de la fluorescencia de ciertos agentes orgánicos cuando están formando un complejo con un ion metálico.
- Temperatura y disolvente: la eficacia cuántica de la fluorescencia disminuye en muchas moléculas con el aumento de la temperatura, ya que el aumento de la frecuencia de las colisiones a temperatura elevada hace aumentar la probabilidad de desactivación no radiante(conversión externa). Una disminución en la viscosidad del disolvente también aumenta la probabilidad de conversión externa y produce el mismo resultado.
- El efecto den pH: La fluorescencia de un compuesto aromático con sustituyentes ácidos o básicos en el anillo depende normalmente del pH. Tanto la longitud de onda como la intensidad de emisión son probablemente diferentes para la forma ionizada y no ionizada del compuesto. Por lo tanto será muy frecuente en los métodos fluorimetros el control del pH.
- Efectos de concentración en la intensidad de fluorescencia: La potencia de radiación fluorescente F es proporcional a la potencia radiante del haz de excitación que es absorbido por el sistema.
Donde es la potencia del haz incidente sobre la disolución y P es su potencia después de atravesar la longitud b del medio. La constante K´ depende de la eficacia cuántica del proceso de fluorescencia. Con objeto de relacionar F con la concentración c escribimos la ley de Beer así:
Donde ε es la absortividad molar de las moléculas fluorescentes y εbc es su absorbancia A.
Sustituyendo nos queda:
Análisis de la fluorescencia
Los distintos componentes de los fluorometros son semejantes a los que existen en los fotómetros o espectro fotómetros de ultravioleta y visible. La figura 6 muestra la configuración caracteristica de los componentes de un fluorometro o un espectrofluorometro. Se utiliza óptica para las variaciones de la fuente.
El haz de la muestra pasa primero a través de un filtro de excitación o un monocromador que sirve para trasmitir aquella parte del has que excitara la fluorescencia, excluyendo las longitudes de onda que se producirán posteriormente de la muestra irradiada. La muestra emite radiación fluorescente en todas direcciones pero se observa mejor perpendicularmente a las de excitación.
En la figura 6 se muestra un fluorometro este se utiliza para la detección de espectros fluorescentes, este instrumento se compone de una fuente de luz, que pasa por un filtro de excitación o monocromador pasa por la muestra, ingresa a un filtro de emisión o monocromador, y apara finalizar por un amplificador diferencial, el cual se reflejara en un dispositivo de lectura.
Espectroscopia de la radiación infrarroja
Esta espectroscopia se fundamenta en la absorción de las moléculas en vibración. Una molécula absorberá la energía de un haz de luz infrarroja cuando dicha energía incidente sea igual a la necesaria para que sea una transición vibracional de la molécula. Es decir, la molécula comienza a vibrar de una determinada manera gracias a la energía que se le suministra mediante luz infrarroja. Pueden distinguirse dos categorías básicas de vibraciones: De tensión y de flexión. Las vibraciones de tensión son cambios en la distancia interatómica a lo largo del eje del enlace entre dos átomos. Las vibraciones de flexión están originadas por cambios en el ángulo que forman dos enlaces. En la figura 7 se representan los diferentes tipos de vibraciones moleculares.
La espectroscopia infrarroja
Detección de las moléculas presentes en el material
En la zona del espectro electromagnético IR con longitudes de onda del infrarrojo medio (entre 4000 y 1300 ) se suelen observar una serie de bandas de absorción provocadas por las vibraciones entre únicamente dos átomos de la molécula. Estas vibraciones derivan de grupos que contienen hidrógeno o de grupos con dobles o triples enlaces aislados. En la zona del espectro electromagnético IR con longitudes de onda comprendidas entre 1300 y 400 (infrarrojo lejano), la asignación de las bandas de absorción a vibraciones moleculares es más difícil de realizar, debido a que cada una de ellas está generada por absorciones individuales sumadas (multiplicidad de las bandas). Es la denominada zona de la huella dactilar (flexión de enlaces CH, CO, CN, CC, etc..). En esta zona de longitudes de onda, pequeñas diferencias en la estructura y constitución de las moléculas dan lugar a variaciones importantes en los máximos de absorción.
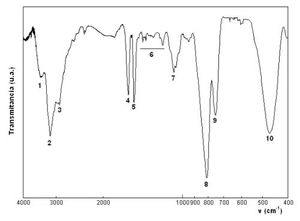
El espectro de infrarrojo del compuesto 1,3 diaminopropano se representa a continuación. En él se observan una serie de bandas de absorción (mínimos de transmisión o transmitancia) que se encuentran numerados del 1 al 10. Comparando la posición de las bandas de absorción observadas en el espectro con la tabla de bandas esperadas, se puede realizar la asignación y comprobar los grupos moleculares presentes en nuestro compuesto:
En la tabla 2 se indican algunos tipos de enlace la frecuencia en en espectro y el tipo de vibracion para empezar a leer los espectros.
En la figura 8 podemos empezar a inteficar los dipolos de enlace, y la la presencia de átomos en el espectro ayudándonos de la tabla 2.
Detección de moléculas
- Disolventes. Al escoger un disolvente debe considerarse no solo su transparencia sino también sus efectos en el sistema absorbente. Los disolventes polares como agua alcoholes esteres y cetonas tienen a obliterar la estructura espectral fina producida por los efectos vibratorios; los espectros se acercan más a los de la fase gaseosa se observa más en disolventes no polares como los hidrocarburos.
Es importante emplear disolventes idénticos cuando se comparan espectros de absorción para fines de identificación.
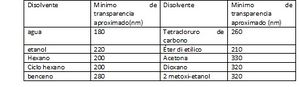
En la figura 9 en cual da un método rápido y simple que emplea fase reversa, combinada con fotometría indirecta visible (433nm). Para la determinación se emplea rojo de metilo, un colorante cromogénico que tiene un gran espectro de absorción UV/luz visible, con un pico máximo de absorción a los 433 nm, que fue usado para la separación cromatográfica. En la tabla 3 aparecen algunos disolventes y la longitud de onda aproximada debajo de la cual no pueden usarse a la absorción. Estos mínimos dependen de la pureza del disolvente.
Métodos para la representación gráfica del espectro
En la figura 10 se muestran espectros de absorción de soluciones de hidróxido de potasio, graficados con 2 tipos de ordenada. La diferenciación de los gráficos de absorbancia es mayor a bajos valores de transmitrancia o elevados valores de absorbancia. Los gráficos que se basan en el logaritmo de la absorbancia como se muestra en la figura 7c, resultan convenientes para la comparación de espectros. Si se escribe la ley de Beer:
Se observa que de todos los términos del lado derecho de la ecuación, solo ε varia con la longitud de onda. Cuando se comparan las gráficas de logA con las de A, resulta evidente la ventaja de las primeras para los estudios de tipo cualitativo. Observece también por el mismo motivo, las gráficas de los ε, resulta también fácilmente comparable.
Detección de grupos funcionales
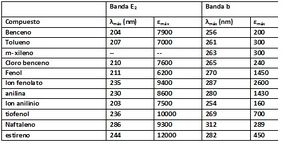
Una débil banda de absorción de la región de 280 a 290 nm que se desplaza hacia longitudes de ondas mas cortas con el aumento de la polaridad del disolvente es una fuerte indicación de la presencia del grupo carbonilo. Una débil banda de absorción de 260nm con indicaciones de la estructura fina vibratoria constituye de una prueba de la presencia de un anillo aromático la confirmación de la presencia de una amina aromática o una estructura feolica puede obtenerse comparando los efectos del pH sobre los espectros de las soluciones que contienen la muestra con los mostrados en la tabla 4 para el fenol y la anilina.
Aunque pueden ocurrir que no proporcionen la clara identificación de un compuesto orgánico, las mediciones de absorción en las regiones visible y ultra violeta son útiles para descubrir la presencia de ciertos grupos funcionales que actúan como cromoferos. [1] En la tabla 5 se muestra las bandas de absorción para cada compuesto orgánico.
Análisis cuantitativo por mediciones de absorción
La espectroscopia de absorción es uno de los instrumentos mas útiles en que se dispone para análisis cuantitativo. Las características mas importantes de los métodos espectrofotométricos y fotométricos:
- Gran aplicación. Una variedad de especies inorgánica y orgánicas absorben las longitudes de onda de la región ultravioleta y visible, y por ello son susceptibles de cuantificación. Muchas especies no son absorbentes pueden analizarse después de ser convertida en especies absorbentes mediante un tratamiento químico apropiado.
- Alta sensibilidad. Las absortividades molares de 10000 a 40000 son comunes, particularmente para los complejos de transferencia de las especies inorgánicas en consecuencia es posible el análisis para concentraciones dentro del intervalo de a M.
- Selectividad de moderada a alta. Puede ser posible encontrar una región de longitud de onda en la que el único componente absorbente de una muestra sea la sustancia que se determina. Cuando existe una superposición parcial de las bandas de absorción, a menudo son posibles las correcciones basadas en más mediciones a otras longitudes de onda. Por lo que puede omitirse el paso de la separación.
- Buena precisión. El error relativo en las mediciones de concentración se encuentra entre los límites de uno a 3% estos errores pueden ser reducidos a unas pocas décimas de porcentaje por medio de unas precauciones especiales.
- Facilidad y comodidad. Se realizan mediciones espectro fotométricas y fotométricas con facilidad y rapidez, usando otro tipo de instrumento.
Espectroscopia atómica
Se basa en la absorción, emisión y fluorescencia de radiación electromagnética por las partículas atómicas. Las regiones del espectro que proporcionan datos atómicos espectrales son de la región ultravioleta y visible y la de los rayos X. Para obtener espectros atómicos de ultravioleta y visible, es necesario atomizar la muestra. En un proceso las moléculas constituyentes se descomponen y se convierten en moléculas gaseosas elementales.
Teoría de la espectroscopia de llama
Cuando se aspira una solución acuosa de sales orgánicas en la llama caliente de un quemador. Por lo que se produce dentro de la llama una solución gaseosa o plasma que contiene partículas elementales. En esta técnica de espectroscopia de llama se utiliza para el análisis la emisión, absorción o fluorescencia de estas partículas.
Tipos de espectroscopia de llama
- Emisión atómica o emisión de llama: se basa en la medida de la potencia radiante de una línea emitida por la sustancia aspirada dentro de una llama caliente.Para separar dicha línea de la radiación producida por la llama así como por los demás constituyentes de la muestra, se emplea un filtro.
- Absorción de llama o absorción atómica: la llama cumple con la misma función que la celda es un espectrofotómetro o fotómetro, se puede considerar que la llama esta constituida por una solución gaseosa diluida en una muestra atomizada en un sitio por medio del dispositivo aspirador y quemador.
- Fluorescencia atómica o fluorescencia de llama. La llama también sirve para formar las partículas atómicas y mantenerlas en un trayecto luminoso por su excitación por una fuente adecuada (fotómetro).
Espectros de Emisión Atómica
A temperatura ambiente, todos los átomos de una muestra se encuentran en el estado fundamental. Por ejemplo, el único electrón externo del sodio metálico ocupa el orbital 3s. la excitación de este electrón a orbitales más altos se pueden conseguir por el calor de una llama o chispa o arco eléctrico. El tiempo de vida de un átomo excitado es breve, y su vuelta del estado fundamental está acompañada de la emisión de un fotón de radiación. Al analizar estas fuentes se aprecia que son más energéticas, que la llama, en las que se alcanzan temperaturas más elevadas, lo cual permite que se puedan realizar determinaciones simultáneas de muchos elementos en una única condición experimental. Además, estas temperaturas son capaces de excitar elementos refractarios, que son compuestos difíciles de descomponer térmicamente, como son el B, P, W, V, incluso, pueden determinar algunos no metales como el S, Cl, Br, I. Espectros de absorción atómica En el medio gaseoso a elevada temperatura, los átomos de sodio son capases de absorber radiación de las longitudes de onda características de las transiciones electrónicas del estado 3s a estados excitados mas elevados. De este modo, un espectro de absorción atómico característico consta de la línea de resonancia que son el resultado de transiciones del estado fundamental a niveles superiores.
Espectros de fluorescencia atómica
En una llama, los átomos pueden presentar fluorescencia cuando se irradia con una fuente intensa que contiene las longitudes de onda que se absorben por el elemento. La radiación que se observa es , por lo general el resultado de la fluorescencia de resonancia.
Espectros moleculares en llama
El hidrógeno o los hidrocarburos utilizados como combustibles producen bandas de absorción y emisión en ciertos intervalos de longitud de onda por la presencia de radicales OH y CN y las moléculas . Algunos metales alcalino-térreos o de las tierras raras forman también hidróxidos que absorben y emiten a través de una amplia gama de longitudes de onda.
En la figura se muestra un ejemplo que corresponde al espectro de emisión y absorción del CaOH. En la cual la línea interrumpida muestra la longitud de onda de la línea de resonancia del bario.
La interferencia del calcio en el análisis del bario por absorción atómica puede evitarse si se emplea una llama caliente que descompone la molécula de CaOH, y hace desaparecer la banda de absorción molecular.
en la figura 10 se muestran espectros de una sustancia solida y liquida, en esta observamos que en los sólidos los espectros son mas angostos y con una cresta mas fina y en los sólidos pasa lo contrario.
- ↑ Skoog Douglas A., Principios de análisis instrumental, Cengage Learning Editores, quinta edición