Diferencia entre revisiones de «Transiciones»
| Línea 154: | Línea 154: | ||
=== Modelos del oscilador | === Modelos del oscilador armónico y del rotor rígido === | ||
Para poder desarrollar la | Para poder desarrollar la ecuación de Schrödinger radial. La cual supondremos para ello que la función de energía potencial V(r) es conocida. Cualquiera que sea la forma que esta adopte podemos expresarla como un desarrollo en serie de Taylor de la coordenada radial r en torno a la distancia de equilibrio re. | ||
Donde el primer termino en este desarrollo es el valor del potencial en el punto de equilibrio. Este valor | Donde el primer termino en este desarrollo es el valor del potencial en el punto de equilibrio. Este valor sitúa en la escala de energía las curvas de potencial de los diferentes estados electrónicos de la molécula. Donde podemos expresar el potencial de la siguiente manera <ref name='Zuñiga'/> | ||
<math>V(r) \approx \frac{k_{e}}{2}(r - r_{e})^{2}</math> | <math>V(r) \approx \frac{k_{e}}{2}(r - r_{e})^{2}</math> | ||
| Línea 167: | Línea 167: | ||
<math>k_{e} = \frac{d^{2} V(r)}{dr^{2}}</math> | <math>k_{e} = \frac{d^{2} V(r)}{dr^{2}}</math> | ||
Esta | Esta aproximación equivale a sustituir la curva de potencial real por la de un oscilador armónico con constante de fuerza k. Estamos usando el modelo del oscilador armónico para representar los movimientos vibracionales de la molécula diatómica. | ||
Sustituyendo el valor del potencial en la | Sustituyendo el valor del potencial en la ecuación radial obtenemos una nueva ecuación de Schrödinger que es | ||
<math>[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} + \frac{k_{e}}{2} (r - r_{e})^{2} ]S(r) = E_{int}S(r)</math> | <math>[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} + \frac{k_{e}}{2} (r - r_{e})^{2} ]S(r) = E_{int}S(r)</math> | ||
Ahora consideremos el termino rotacional. Podemos expresarlo | Ahora consideremos el termino rotacional. Podemos expresarlo también como un desarrollo de Taylor de la distancia internuclear r en torno al valor de equilibrio <math>r_e</math>. Para valores de r próximo a <math>r_{e}</math> los sucesivos términos de este desarrollo se hacen cada vez mas pequeños y, en primera aproximacion, podemos quedarnos únicamente con el primer termino. Escribimos por tanto. | ||
<math> \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} \approx \frac{J(J+1)\hbar^{2}}{2\mu re^{2}}</math> | <math> \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} \approx \frac{J(J+1)\hbar^{2}}{2\mu re^{2}}</math> | ||
Lo que estamos haciendo es suponer que la distancia internuclear se mantiene fija en us valor de equilibrio conforme rota la | Lo que estamos haciendo es suponer que la distancia internuclear se mantiene fija en us valor de equilibrio conforme rota la molécula, es decir, estamos usando el modelo del rotor rígido para describir el movimiento rotacional. Por lo tanto obtenemos la siguiente ecuación. | ||
<math>[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r_{e}^{2}} + \frac{k^{e}}{2} (r - r_{e})^{2} ]S(r) = E_{int}S(r)</math> | <math>[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r_{e}^{2}} + \frac{k^{e}}{2} (r - r_{e})^{2} ]S(r) = E_{int}S(r)</math> | ||
que es la | que es la ecuación radial para los modelos del oscilador armónico y del rotor rígido. | ||
Por consiguiente podemos obtener la | Por consiguiente podemos obtener la energía obteniendo la siguiente ecuación | ||
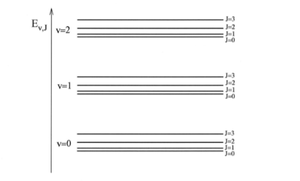
[[Archivo:Imagen_30.png|300px|thumb|right|Figura 5:Niveles de | [[Archivo:Imagen_30.png|300px|thumb|right|Figura 5:Niveles de Energía de rotación y vibración para una molécula diatómica]] | ||
<math>E_{v, J} = (\upsilon + 1/2) h\nu_{e} + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}_{e}}</math> | <math>E_{v, J} = (\upsilon + 1/2) h\nu_{e} + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}_{e}}</math> | ||
donde <math>\nu_{e}</math> es la frecuencia vibracional | donde <math>\nu_{e}</math> es la frecuencia vibracional armónica | ||
<math>\nu_{e} = \frac{1}{2\pi} (\frac{k_{e}}{\mu})^{1/2}</math> | <math>\nu_{e} = \frac{1}{2\pi} (\frac{k_{e}}{\mu})^{1/2}</math> | ||
| Línea 197: | Línea 197: | ||
<math>B_{e} = \frac{h}{8 \pi \mu r^{2}_{e}}</math> | <math>B_{e} = \frac{h}{8 \pi \mu r^{2}_{e}}</math> | ||
Por lo tanto escribimos a | Por lo tanto escribimos a energía de vibración y rotación de la molécula diatómica como sigue | ||
<math>E_{v, J} = (\upsilon + 1/2) h\nu_{e} + J(J+1)h B_{e}</math> | <math>E_{v, J} = (\upsilon + 1/2) h\nu_{e} + J(J+1)h B_{e}</math> | ||
Como vemos, esta | Como vemos, esta energía viene dada por la suma de la energía armónica para los niveles vibracionales y la del rotor rigido para los niveles rotacionales. Para la mayoría de ellas se cumple que<math>\nu_{e} >> Be</math>. Esto se debe fundamentalmente a que la frecuencia vibracional <math>\nu_{e}</math> es inversamente proporcional a <math>\mu^{1/2}</math>, mientras que Be es inversamente proporcional a <math>\mu</math>. La energía de los niveles vibracionales es mucho mayor que la energia de rotacion. De acuerdo con eso, los niveles vibracional, se dan de la forma siguiente Figura 5 | ||
=== Reglas de Seleccion === | === Reglas de Seleccion === | ||
Revisión del 14:09 4 dic 2011
Introducción
La mayoría de nuestra información experimental sobre los niveles de energía de los atomos y las moléculas proviene de la espectroscopia, el estudio de la absorción y emisión de radiación electromagnética (luz) por la materia. La espectroscopia es el principal medio de investigación del nivel molecular. La espectroscopia permite encontrar estructuras moleculares (conformaciones, longitudes de enlace y ángulos) y frecuencias moleculares de vibracion.
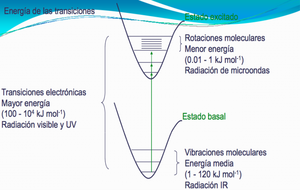
La frecuencia a la que se absorbe o emite energía esta relacionada con los niveles de energía implicados en la transición por la energía del fotón que usa en las espectroscopias. Las transiciones entre los niveles de energía rotacional y vibracional están a medio camino entre estos 2 extremos, teniendo los niveles de energía rotacional un espaciado menor que los vibracionales. El espectro electromagnético se describe en la figura 1
Los espectroscopistas usan comúnmente la cantidad numero de ondas, que tiene unidades de centímetros inversos, en lugar de la longitud de onda o la frecuencia, para designar las transiciones espectrales.
Pasamos ahora de la descripción clásica de la mecanocuantica que implica a los niveles discretos de energía. Los procesos básicos que tienen lugar en las transiciones asistidas por fotones son la absorción, la emisión espontánea y la emisión estimulada.
En absorción, el fotón incidente induce una transición a niveles elevados y en emisión, se emite un fotón cuando el estado excitado se relaja a uno de energía inferior. La absorción y la emisión estimulada son iniciados por un fotón que incide sobre la molécula de interés. Como da a entender el nombre, la emisión estimulada es un suceso aleatorio y su velocidad esta relacionada con el tiempo de vida media del estado excitado.
La emisión espontánea y estimulada difieren en un aspecto importante. La emisión espontánea es un proceso completamente al azar, y los fotones emitidos son incoherentes, lo que quiere decir que sus fases y su dirección de propagacion son aleatorias.
El hecho de que se observen un numero de transiciones vibracionales en una transición electrónica es muy útil para obtener información detallada sobre ambas superficies de energía potencial, la fundamental y la del estado electrónico para que ocurre la transición. Debido a que frecuentemente, se observan múltiples picos vibracionales en los espectros electrónicos, la fuerza de enlace de la molecula en los estados excitados se puede determinar ajustando las frecuencias de las transiciones observadas a un potencial como el potencial de Morse.[1]
Rotación y Vibración de moléculas diatómicas
Iniciamos con el estudio de la espectroscopia molecular, que engloba las transiciones que se producen entre los niveles de energía rotacionales, vibracionales y electrónicos de una molécula, lo que da, respectiva mente, a los espectros de microondas, infrarrojo y visible-ultravioleta. Comenzaremos por describir las moléculas mas sencillas, las diatomicas, en las que el pequeño numero de grados de libertad internucleares que poseen, uno vibracional y 2 rotacionales, facilita en gran medida la descripción conceptual y matemática de estos tipos de movimientos. Desarrollaremos primero el tratamiento cuántico de los movimientos de vibración y rotación de moléculas diatomicas. La espectroscopia molecular es mucho mas variada que la atómica por lo que origina mas complejidad de los sistemas moleculares. Esta complejidad se pone claramente de manifiesto al escribir el operador Hamiltoniano, que viene dado por:
donde y denotan los núcleos y los índices i y j a los electrones. Donde los 2 primeros términos del hamiltoniano son los operadores energía cinética de los núcleos y los electrones, y los 3 últimos son los operadores energía potencial correspondientes, respectiva mente, son las interacciones coulombianas atractivas entre núcleos y electrones, las repulsivas entre los núcleos y las repulsivas entre los electrones. Por lo que la ecuación de Schrödinger molecular se puede denotar de la siguiente manera
Donde y simbolizan a las coordenadas electrónicas y nucleares, y donde son los operadores energía cinética nuclear, energía cinética electrónica y energía potencial coulombiana total.
Para resolver esta ecuación podemos aprovechar la gran diferencia de movilidad existente entre los electrones y los núcleos de la molécula. La masa de los núcleos es mucho mayor que la de los electrones. Como consecuencia los electrones se mueven mucho mas rápido que los núcleos en el interior del campo de las fuerza culombicas de la molécula. Esta gran diferencia de movilidad permite tratar por separado los movimientos electrónicos y nucleares, lo que constituye la denominada aproximación de Born-Oppenheimer, por lo que podemos simplificar el hamiltoniano molecular en [2].
Por lo que podemos denotar la ecuación de Schrödinger electrónica de la siguiente manera
Las distancias internucleares toman valores específicos correspondientes a diferentes configuraciones internucleares. Hemos de resolver, por tanto, la ecuación Schrödinger electrónica para cada configuración internuclear. Esto proporciona un conjunto de funciones propias y energías electrónicas
Para estudiar los movimientos nucleares aproximamos las funciones de onda moleculares totales , para un estado electrónico dado, como el producto de la función propia electrónica por una función propia nuclear , es decir escribimos
Escribiendo esta ecuación, en la ecuación de Schrödinger molecular, obtenemos la ecuación de Schrödinger nuclear que escribimos de la siguiente manera
El operador Hamiltoniano en esta ecuacion esta formado por la energia cinetica nuclear, mas la energia electronica dependiente de las coordenadas nucleares. Esta energia se le puede interpretar como la energia potencial efectiva
Consideremos una molecula diatomica por los nucleos a y b cuya localizacion en el espacio se especifica utilizando un sistema de coordenadas cartesianas xyz.Los vectorees de posicion de los nucleos son y . Por lo tanto la ecuacion de Schrodinger nuclear se escribe de la siguiente manera.
donde se observa que la funcion de energia potencial V(r) depende solamente de la coordenada internuclear. La ecuacion de Schrodinger nuclear para una molecula diatomica es una ecaucion diferencial en derivadas parciales de las 6 coordenadas. Estas coordinadas no distinguen los grados de libertad fisicos asociados a los movimientos translacionales, rotacionales y vibracionales de la molecula. Por lo tanto necesitamos transformar la ecuacion para poder destinguir los grados de libertad. Primero separamos el movimiento translacional de la molecula como un todo, de los movimientos internucleares. El movimiento translacional viene dado por el vector de posicio del centro de masas R, donde
y el vector de dezplazamiento relativo r que esta definifo por
Realizando este cambio de coordenadas obtenemos la ecuacion de Schrodinger nuclear
donde M = ma + mb es la masa total de la molecula y
El hamiltoniano nuclear en esta ecuacion esta formado por 2 claramente diferenciadas, una contiene la energia cinetica translacional, dependiente solamente de las coordenadas de las centro de masas , y otra que incluye la energia cinetica y la energia potencial, ambas dependientesde las coordenadas internucleares. Por lo tanto podemos separar entonces de forma exacta los movientos translacional e interno, escribiendo las funciones de ondas nucleares como el producto de una funcion de onda translacional y una funcion de onda interna, es decir
Las ecuaciones de valores propios traslacional e interna son, respectivamente
y
La ecuacion de Schrodinger traslacional es formalmente identica a la del movimiento de una particula ficticia de masa reducida , sujeta a una funcion de potencial de simetria esferica V(r). Para resolver conviene utilizar coordenadas polares esfericas (r, ,), en lugar de coordenadas cartesianas. Esta transformacion de coordenadas permite identificar por un lado el movimiento vibracional de la molecula, asociado a la coordenada radial r, y por otro lado los movimientos rotacionales, asociados a las coordenadas angulares y . La ecuacion de Schrodinger internuclear en coordenadas polares es
donde es el operador momento angular total al cuadrado. Por lo tanto se cumplen las ecuaciones de valores propios
J = 0,1,2
M = -J, -J + 1,.......,J-1,J
donde J y M son los numeros cuanticos de los operadores momento angular. Las funciones propias de estos operadores son los armonicos esfericos , asi que podemos escribir las funciones propias del Hamiltoniano internuclera de la forma
donde R(r) es una funcion a determinar, dependiente unicamente de la coordenada radial.
La ecuacion anterior se puede siplificar de la siguiente manera
Esta ecuacion radial se puede simplicar mas si usamos un cambio de variable el cual es
donde nuestra ecuacion resulta de manera siguiente
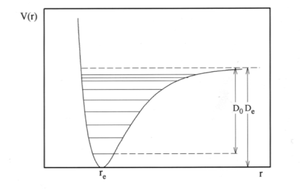
Las sucesivas transformaciones que hemos realizado para describir los movimientos nucleares de la molecula diatomica en terminos de movimientos translacionales, rotacionales y vibracionales, nos ha permitido simplificar el problema de la ecuacion de Schrodinger nuclear. Para resolver la ecuacion radial, y obtener los niveles de energia y funciones de onda de vibracion y rotacion de la molecula diatomica, hemos de disponer de la funcion de energia potencial V(r) que controla los movimientos internucleares. Como se observo anteriormente la funcion de potencial se obtiene resolviendo la ecuacion de Schrodinger electronica para diferentes valores de coordenada internuclear r. En la figura 3 se muestra la curva de potencial.
Cuando los nucleos se acercan mucho entre si, es decir, cuando r tiende a cero, predominan las interacciones repulsivas entre las nubes electronicas de cada uno de ellos y las interacciones repulsivas entre los propios nucleos, de manera que la energia potencial tiende a infinito, formando una pared repulsiva.
Sin embargo, a medida que aumenta la distancia internuclear r, la energia potencial va disminuyendo hasta alcanzar un minimo a la distancia de equilibrio re. Apartir de esta distancia la energia potencial vuelve a aumentar, pero ahora acaba tendiendo asintoticamente hacia un valor limite constante, que da cuenta de la disociacion de la molecula es sus atomos separados.
Los niveles de energia vibracionales comprendidos entre el minimo de la curva de potencial y el limite disociativo estan cuantizados debido al caracter enlazante de la curva en esa zona, y los niveles vibracionales por encima del limite disociativo forman un continuo que describe los estados disociativos de la molecula.
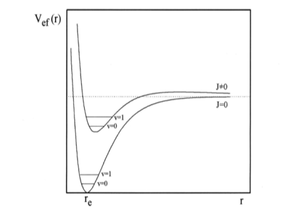
Antes de resolver la ecuacion radial conviene que nos hagamos una idea mas clara de como vibra y rota la molecula. Para ello utilizaremos el denominado potencial efectivo, Vef, que se define de la forma
y que permite expresar la ecuacion radial como sigue
Esta ecuacion de valores propios puede entenderse como la correspondencia al movimiento de la particula de masa a lo largo de la coordenada unidimensional r, sujeta a la funcion de potencial
Supongamos que J = 0. La molecula no tiene entonces momento angular y, por tanto, no rota, con lo que el potencial efectivo se reduce al potencial real, es decir, tenemos la distancia de equilibrio en terminod clasicos. Donde para un nivel de energia vibracional dado, la molecula esta oscilando en torno a la distancia de equilibrio y, enterminos clasicos, las distancisa de maximo y minimo acercamiento de los nucleos vienen dados por el punto de corte del nivel de energia con la curva de potencial. Supongamos ahora J 0. La molecula en este caso rota y vibra simultaneamente, y el potencial efectivo tiene la forma general que se muestra en la figura 4, para valores moderados de J. El nivel vibracional en que estaba la molecula con J=0 se dezplaza hacia arriba, empujando por la contribucion rotacional del potencial efectivo, y los puntos de retorno clasico aumentan. El movimiento rotacional produce, un estiramiento adicional de las elongaciones vibracionales, es decir, se desplaza a los nucleos hacia afuerta conforme rota la molecula o, de otro modo, provoca un alejamiento centrifugo de los mismos.
Modelos del oscilador armónico y del rotor rígido
Para poder desarrollar la ecuación de Schrödinger radial. La cual supondremos para ello que la función de energía potencial V(r) es conocida. Cualquiera que sea la forma que esta adopte podemos expresarla como un desarrollo en serie de Taylor de la coordenada radial r en torno a la distancia de equilibrio re.
Donde el primer termino en este desarrollo es el valor del potencial en el punto de equilibrio. Este valor sitúa en la escala de energía las curvas de potencial de los diferentes estados electrónicos de la molécula. Donde podemos expresar el potencial de la siguiente manera [2]
donde
Esta aproximación equivale a sustituir la curva de potencial real por la de un oscilador armónico con constante de fuerza k. Estamos usando el modelo del oscilador armónico para representar los movimientos vibracionales de la molécula diatómica.
Sustituyendo el valor del potencial en la ecuación radial obtenemos una nueva ecuación de Schrödinger que es
Ahora consideremos el termino rotacional. Podemos expresarlo también como un desarrollo de Taylor de la distancia internuclear r en torno al valor de equilibrio . Para valores de r próximo a los sucesivos términos de este desarrollo se hacen cada vez mas pequeños y, en primera aproximacion, podemos quedarnos únicamente con el primer termino. Escribimos por tanto.
Lo que estamos haciendo es suponer que la distancia internuclear se mantiene fija en us valor de equilibrio conforme rota la molécula, es decir, estamos usando el modelo del rotor rígido para describir el movimiento rotacional. Por lo tanto obtenemos la siguiente ecuación.
que es la ecuación radial para los modelos del oscilador armónico y del rotor rígido. Por consiguiente podemos obtener la energía obteniendo la siguiente ecuación
donde es la frecuencia vibracional armónica
e introduciendo la constante rotacional Be, definida de la forma
Por lo tanto escribimos a energía de vibración y rotación de la molécula diatómica como sigue
Como vemos, esta energía viene dada por la suma de la energía armónica para los niveles vibracionales y la del rotor rigido para los niveles rotacionales. Para la mayoría de ellas se cumple que. Esto se debe fundamentalmente a que la frecuencia vibracional es inversamente proporcional a , mientras que Be es inversamente proporcional a . La energía de los niveles vibracionales es mucho mayor que la energia de rotacion. De acuerdo con eso, los niveles vibracional, se dan de la forma siguiente Figura 5
Reglas de Seleccion
Una vez obtenidos los niveles de energia y las funciones de onda de vibracion y rotacion de las moleculas diatomicas, podemos pasar a determinar las reglas de seleccion que controlan las transiciones radiativas entre estos niveles. Las reglas de seleccion mas fuertes son las de dipolo electrico y se obtienen calculando el momento dipolar de transicion electrico. En el marco de separacion de Born-Oppenheimer, las funciones de onda moleculares vienen dadas por el producto de la funcion de onda electronica y la nuclear, es decir
Para las transiciones entre 2 estados moleculares, y en las que el estado electronico no cambia es decir, para transiciones dentro de la misma curva de energia potencial, el momento dipolar de transicion viene dado por
Ahora evaluando la integral obtenemos como varia el momento dipolar electrico permanente. Supongamos primero que la molecula diatomica es homonuclear. En este caso no hay separacion neta de carga electronicas puesto que los nucleos son iguales. El momento dipolar electrico permanente de la molecula es nulo (). Las transiciones de dipolo electrico entre niveles de energia de vibracion y rotacion de moleculas diatomicas homonucleares estan, pues, prohibidas, y estas moleculas no presentan, por tanto, espectro vibracion rotacion. Veamos que ocurre con las moleculas diatomicas heteronucleares. En estas moleculas si que hay separacion neta de carga con respecto a los nucleos, por lo que el momento dipolar electrico permanente es diferente de cero () .
La regla de seleccion es, por tanto, , es decir, el numero cuantico vibracional no cambia. Solo cambia entonces el numero cuantico rotacional, de modo que las transiciones se producen entre estados con el mismo numero cuantico vibracional v y diferente numero cuantico rotacional J. Estas transiciones dan lugar al denominado espectro de rotacion pura de la molecula.
Cuando toma valores distintos de cero solo cuando los numeros cuanticos vibracionales difieren en una unidad, de manera que la regla de seleccion es. Ahora si que cambia el numero cuantico vibracional, ademas de los rotacionales, estas transiciones dan lugar al espectro de vibracion-rotacion de la molecula.
Espectro de rotacion pura
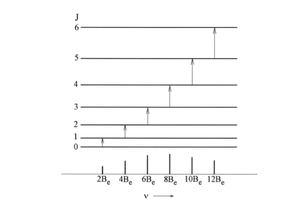
Veamos que forma tienen los espectros de vibracion y rotacion de moleculas diatomicas, de acuerdo con la regla de seleccion que acabamos de deducir. Comencemos por los espectros de rotacion pura, que son aquellos en los que no cambia el numero cuantico vibracional. La regla de seleccion rotacional es . En una transicion de absorcion entre 2 estados rotacionales con numeros cuanticos inicial y final, usando la siguiente ecuacion podemos obtener los numeros de ondas de las lineas espectrales.[2]
Podemos simplificar la siguiente ecuacion de esta forma
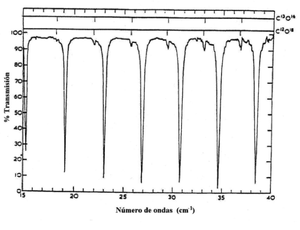
Entonces tenemos que el espectro rotacional consiste en una serie de lineas espectrales que aparecen en los numeros de ondas 2Be, 4Be, 6Be, y estan equiespaciadas. Los valores son normalmente de , salvo para moleculas muy ligeras para las que pueden llegar a alcanzar las decenas de . De acuerdo con estos valores, los espectros de rotacion pura se observan habitualmente en la region de microondas, que va aproximadamente desde 0.03 hasta 10 cm, y se extienden hacia el infrarrojo lejano. En la siguiente figura se muestra el espectro rotacional del CO.
Espectro de vibracion-rotacion
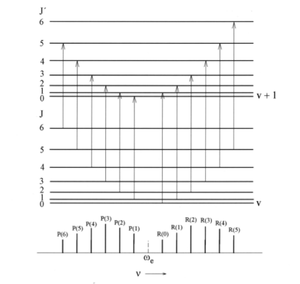
Veamos que ocurre con las transiciones en las que cambian los numeros cuanticos vibracional y rotacional. Para entender como aparece el espectro en este caso conviene utilizar primero los modelos del oscilador armonico y del rotor rigido. Las reglas de seleccion son , , y , , y los niveles de energia, en , vienen dador por la ecuacion
Supongamos que el espectro de absorcion. El numero cuantico vibracional v aumenta en este caso, en una unidad , , pero el numero cuantico rotacional J puede aumentar , , o disminuir , ,tambien en una unidad, y los numeros de ondas correspondientes a estos 2 tipos de transiciones vienen dados por
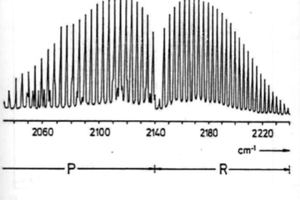
El espectro de vibracion-rotacional se genera entonces de la forma que se muestra en la siguiente figura.
El espectro aparece centrado en el numero de onas , , y sus lineas se situan a ambos lados del mismo dependiendo de que el numero cuantico J aumente en la transicion ( J)
, lo que da a lugar a la denominada rama R (\triangle J = +1) del espectro, o que J disminuya en la transicion, lo que origina la rama P (\triangle J = -1). Las lineas de cada rama se denotan de la forma R(J) o P(J), donde J es el numero cuantico rotacional del estado de energia mas baja. El espaciado entre las lineas en ambas ramas es constante. [2]
Transiciones Electronicas
Anteriormente se introdujo la espectroscopia y los conceptos basicos relevantes para las transiciones entre los niveles de energia de una molecula. Recordemos que el espaciado de la energia entre los niveles rotacionales es mucho menor que el espaciado entre los niveles vibracionales. Mientras que las transiciones rotacionales y vibracionales son inducidas por la radiacion de microondas e infrarroja, las transiciones electronicas se inducen por la radiacion visible y ultravioleta (UV), por ejemplo en la figura 10 se muestra un esquema de todas las transiciones.
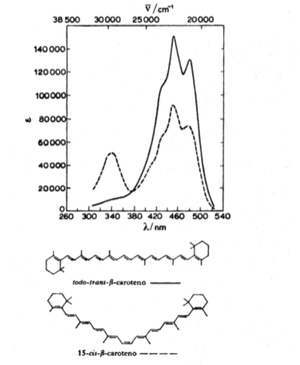
Las excitaciones electronicas son responsables del color a los objetos que observamos, ya que el ojo humano es sensible a la luz solamente en el rango limitado de longitudes de onda en las que ocurren algunas transiciones electronicas. Debido a que la espectroscopia electronica de una molecula esta directamente ligada a sus niveles de energia, que, a su vez, estan determiandos por su estrucutra y composicion quimica, la espectroscopia visible-UV constituye una herramienta cualitativa muy buena para identificar a las moleculas. En la figura 11 se muestra un espectro UV-Visible de la molecula del caroteno.[3]
Las moleculas diatomicas tienen los espectros electronicos mas facilmente interpretables, por que el espaciado entre los diferentes estados electronico-vibracional-rotacional es suficientemente grande como para permitir que se resuelvan los estados individuales. La longitud de enlace de las moleculas en estados excitados es, generalmente, mayor y la energia de enlace menor que la del estado fundamental. Esto se debe a que los estados excitados, generalmente, tienen un amyor caracter antienlazante que los estados fundamentales, y la disminucion del orden de enlace da lugar a una energia de enlace mas pequeña, una longitud de enlace mayor y una frecuencia vibracional mas baja para las especies en estados excitados.
La espectroscopia lleva consigo transiciones entre estados moleculares, las reglas de seleccion para las transiciones electronicas moleculares estan bastante bien definidas para las moleculas diatomicas de bajo peso molecular en las que el acoplamiento espi-orbita no es importante. Asi ocurre si el numero atomico de los atomos, Z, es menor que 40.
Para estas moleculas, las reglas de seleccion so
y
Recordemos que es la componente del momento angular orbital total L segun el eje molecular. El valor se aplica a la transicion y se plica a las transiciones. Otras reglas de seleccion estan asociadas a las paridades +/- y g/u. Para diatomicas homonucleares, las transiciones estan permitidas, pero las transiciones estan prohibidas. Las transiciones y estan permitidas, pero las transiciones estan prohibidas.
Cada uno de los estados enlazantes moleculares tienen niveles de energia vibracionales y rotacionales bien definidos. Similarmente, los numeros cuanticos vibracionales y rotacional pueden cambiar durante la excitacion electronica. El principio de Franck-Gordon establece que las transiciones entre los estados electronicos correspondena a lineas verticales en un diagrama energia frente a la distancia internuclear. La base de este principio es que las transiciones electronicas ocurren en una escala de tiempo que es muy corto comparado con el periodo vibracional de una molecula. La probabilidad de una transicion vibronica esta gobernada por el soplamiento entre las funciones de onda final e inicial para valores fijos de las diastancias internucleares. Las transiciones espectrales mas intensas tienen lugar a los estados vibracionales del estado electronico superior que tienen el solapamiento mayor con él estado vibracional fundamental en el estado electronico mas bajo.
Pese a que esta transicion tienen el maximo solapamiento y genera la linea espectral mas intensa, otros estados en energia al estado mas probable darab lugar a lineas espectrales que tengan una intensidad baja. Sus intensidades son bajas debido a que las funciones de onda vibracionales de los estados fundamental y excitados tienen solapamientos mas pequeños.[3]
Transiciones de moleculas poliatomicas
En una transicion electronica en moleculas poliatomicas son posibles muchas transiciones rotacionales y vibracionales. Las moleculas grandes tienen grandes momentos de inercia, y generan niveles de energia rotacionales muy proximos. Una molecula grande puede tener cerca de 1000 niveles rotacionales en un intervalo de . Por esta razon, las lineas espectrales individuales se solapan de forma que se observan, frecuentemente, bandas anchas en la espectroscopia de absorcion UV-Visible. Una transicion electronica en una molecula diatomica tiene una estructura resultante de las transiciones vibracionales y rotacionales que pueden, a menudo, resolverse en los picos individuales. Sin embargo, las numerosisimas transiciones rotacionales y vibracionales posibles en una molecula poliatomica, generalmente solapan, dando lugar a una banda ancha, casi sin estructura. Este solapamiento hace dificil extraer informacion sobre los estados inicial y final involucrados en una transicion electronica de una molecula poliatomica.[3]
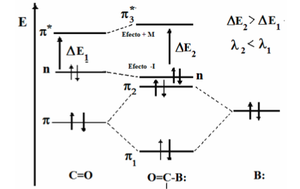
La excitacion fundamental es la promicion de un electron desde su HOMO a un OM del estado excitado. Consideremos el formaldehido y las correspondientes a sus estados electronicos excitados mas bajos. En un modelo de enlaces localizados, los electrones 2s y 2p se combinan para formar los orbitales . Se nota que los electrones 1s y ´2s del oxigeno y los electrones 1s del carbono permanecen localizados en los atomos y no estan implicados en el enlace. Hay tambien un par solitario de electrones en un OM antienlazantem designado por , localizados en el atomo de oxigeno. Los orbitales estan primariamente localizados en los atomos adyacentes C-H o C-O. Los enlaces C-H y uno de los enlaces C-O son enlaces , el enlace C-O restante es un enlace .
Como podemos observar en la figura 13, el diagrama de energia del OM, concluimos que el orbital noenlazante del O obtenido del OA 2p es el HOMO, y el orbital vacio es el LUMO. El estado excitado mas bajo se obtienen promocionando un electron desde el orbital al y se denomina una transicion . El siguiente estado excitado se obtiene promociando un electron desde el OM al y se denomina transicion . Sin embargo, como ocurrio con los atomos, estas configuraciones no describen completamente los estados cuanticos, debido a que la alineacion de espin en los orbitales llenos no se especifica en la configuracion. Como cada una de las configuraciones excitadas relacionadas tiene 2 orbitales semillenos, aparecen los 2 estados singletes y triplete para cada configuracion.
La diferencia de energia entre los estados inicial y final determina la frecuencia de la linea espectral. Pese a que las grandes variaciones pueden ocurrir entre moleculas diferentes, para un tipo de transicion dada, generalmente, aumenta la energia en la secuencia , y .
El estado fundamental es, en general, un estado singlete y los estados excitados pueden ser bien estados singletes o tripletes. Incluimos solo un estado excitado singlete y uno triplete, ademas del estado fundamental y consideramos las transiciones posibles entre estos estados. Los niveles rotacionales se omiten. La regla fundamental que gobierna las transiciones es que toda transicion debe conservar la energia y el momento angular. Para las transiciones en una molecula, esta condicion se puede satisfacer transfiriendo energia entre estados electronicos, vibracionales y rotacionales. Alternativamente, la energia se puede conservar transfiriendo energia entre una molecula o del entorno.
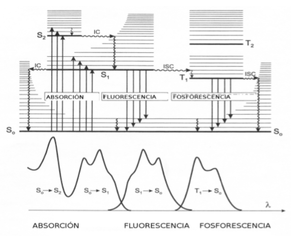
Fluorescencia y Fosforescencia
Las transiciones radiativas, en las que un foton se absorbe o emite, se indican por lineas verticales solidas. Las transiciones no radiativas, en las que la energia se transfiere entre diferentes grados libertad de una molecula o del entorno, se indican por lineas verticales onduladas. Las lineas de trazos indican las transiciones no radiativas entre los estados singletes y entre estados singletes y tripletes, que estan prohibidas por la regla de seleccion de dipolo. La molecula en el estado excitado puede volver al estado fundamental a traves de transiciones radiativas y no radiativas que llegan consigo colisiones con otras moleculas. Las molecula aislada en el estado ( por ejemplo, en el espacio interestelar) no puede intercambiar energia con otras moleculas mediante colisiones y, por tanto, tendran lugar transiciones no radiativas, sin embargo, las moleculas en el estado excitado en un cristal, en disolucion o en ún gas, sufren frecuentes colisiones con otras moleculas en las que pierden energia y vuelven al estado vibracional mas bajo de S1. Este proceso ocurre en general mucho mas rapidamente que la transicion radiativa directa desde el estado excitado vibracionalmente en S1 a un estado vibracional en S0. Un ejemplo de una transicion no radiativa inducida por colisiones, es la conversion interna, que es el paso isoenergetico desde un estado vibracional elevado del estado excitado vibracional del nivel electronico fundamental de la misma multiplicidad.[3] Una vez que la molecula puede sufrir una transicion radiativa a un estado vibracional del S0 en un proceso denominado flurescencia, o puede sufrir una transicion no radiativa a un estado vibracional excitado de T1 en un proceso denominado cruce entre sistemas, que esta prohibido en la aproximacion de Born-Oppenheimer y, por tanto, ocurre a velocidad muy baja, en comparacion con los otros procesos. Debido a que la relajacion vibracional al estado vibracional fundamental de S1 es generalmente rapida en comparacion con la fluorescencia a So, la molecula en el estado excitado vibracionalmente se relajara al estado vibracional fundamental de S1 antes de sufrir fluorescencia.
Aunque el cruce el sistema entre los estados singlete y triplete esta prohibido en la aproximacion de Born-Oppenheimer, para muchas moleculas la probabilidad de que esto ocurre es alta. Es probabilidad se ve reforzada por 2 factores: una geometria molecular muy parecida en los estados singlete y triplete, y un fuerte acoplamiento espin-orbita, que permite que ocurra el cambio de espin asociado a la transicion singlete-triplete.
Imaginemos que se excita una molecula de So a S1. Esta transicion permitida de dipolo, de forma que hay una elevada probabilidad de que ocurra. Mediante colision con otras moleculas, la molecula del estado excitado pierde energia vibracional y decae al estado vibracional mas bajo S1. Las curvas de energia potencial se pueden cruzar, de forma tal que un estado vibracional excitado de S1, intermedio en energia entre el estado al que ocurre la excitacion original y el estado vibracional excitado de T1. Sin embargo vibracional fundamental de T1, la molecula puede decaer radiativamente al estado fundamental mediante el proceso de transicion dipolo prohibido, denominado fosforescencia. El tiempo de vida del estado vibracional fundamental de T1 puede ser muy grande comparado con un periodo vibracional. Por tanto, los procesos no radiativos implicados en las colisiones entre las moleculas o con las paredes del recipiente de reaccion, pueden competir de modo efectivo con la fosforescencia. Debido a que es una transicion prohibida y debido a la competencia con los procesos no radiativos, la probabilidad de que ocurre una transicion fosforescente de T1---S0 es, generalmente, mucho menor que la fluorescencia. En la figura 14 se muestra un equema de la fluorescencia y fosforescencia.[3]





![[\hat{T}_{nuc.} (r_{\alpha}) + \hat{T}_{ele.} (r_{i}) + \hat{V}_{C} (r_{i}, r_{\alpha})] \psi(r_{i}, r_{\alpha}) = E\psi (r_{i}, r_{\alpha})](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/d9c4caf0ac6640705e5100ca2efe12229586f3a7)




![[\hat{T}_{ele.} (r_{i}) + \hat{V}_{C} (r_{i}, r_{\alpha})] \psi(r_{i}, r_{\alpha}) = E\psi (r_{i}, r_{\alpha})](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/59e958d74501c3feb275e34db5b111339c0bd1dd)




![[\hat{T}_{ele.} (r_{i}) + \hat{V}_{C} (r_{i}, r_{\alpha})] \psi_{ele.}(r_{i}, r_{\alpha}) = E_{ele.}\psi (r_{i}, r_{\alpha})](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/99374bfbfe058aa8646d9ea1ffeb95d36772b2a5)
![[ - \frac{\hbar}{2} \sum_{\alpha} \frac{1}{m_{\alpha}} \nabla^{2}_{\alpha} + U(r_{\alpha}) ] \psi_{nuc.}(r_{\alpha}) = E\psi_{nuc.} (r_{\alpha})](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/6e333755c4d152aa1abb13e38209667977006fee)


![[ - \frac{\hbar}{2 m_{a}} \nabla^{2}_{a} - \frac{\hbar}{2 m_{b}} \nabla^{2}_{b} + V(r) ] \psi_{nuc.}(r_{a}, r_{b}) = E\psi_{nuc.} (r_{a}, r_{b})](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/09389f556f58f054f69463d520a3653c1fa9eb0c)



![[-\frac{\hbar^{2}}{2M}\nabla^{2}_{R} - \frac{\hbar^{2}}{2\mu} + V(r) ] \psi_{nuc}(R, r) = E\psi_{nuc}(R, r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/4161c413a2c1ee6c2f1a16dba3f9de04ee5483e7)



![[-\frac{\hbar^{2}}{2M}\nabla^{2}_{R}] \psi_{tras}(R) = E\psi_{tras}(R)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/2167a0fac880406aa651307aa624e5acdaa0169a)
![[- \frac{\hbar^{2}}{2\mu} + V(r) ] \psi_{int}(r) = E\psi_{int}(r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/77238a29e12b492e49effaa4276600d4ee15de15)



![[-\frac{\hbar^{2}}{2\mu} ( \frac{\partial^{2}}{\partial r^{2}} + \frac{2\partial}{r\partial r} ) + \frac{\hat{L}^{2}}{2\mu r^{2}} + V(r) ] \psi_{int}(r, \theta, \phi) = E_{int}\psi_{int}(r, \theta, \phi)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/06f23612d86179aefb39f1d3edcf1b983013f45e)






![[-\frac{\hbar^{2}}{2\mu} ( \frac{\partial^{2}}{\partial r^{2}} + \frac{2\partial}{r\partial r} ) + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} + V(r) ] R(r) = E_{int}R(r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/944c9c4818d6ea10c8a49cf852b9b09f47fa0ac2)

![[-\frac{\hbar^{2}}{2\mu} \frac{\partial^{2}}{\partial r^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} + V(r) ] S(r) = E_{int}S(r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/67f458501f22da8ae32ff8245a4fada85dce3c68)

![[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + V_{ef.}(r)] S(r) = E_{int}S(r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/1b0ef5325af0aef54d1e79c129be411ea381caea)





![[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r^{2}} + \frac{k_{e}}{2} (r - r_{e})^{2} ]S(r) = E_{int}S(r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/ae6eb0df7c62ddfedf2f8851262d62ceb71a1fee)


![[- \frac{\hbar^{2}d^{2}}{2\mu dr^{2}} + \frac{J(J+1)\hbar^{2}}{2\mu r_{e}^{2}} + \frac{k^{e}}{2} (r - r_{e})^{2} ]S(r) = E_{int}S(r)](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/4b03484bbbedc16c0109e9cd7fe560e71ee5490a)












![\tilde{\nu}(J--- J+1) = 2 (J+1)[ Be - \alpha_{e} (\nu + 1/2 )] -4De (J + 1)^{3}](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/d611dd6dbf5929422419a11047fd014cc46613da)




![\tilde{\nu_{R}} [ \upsilon ----> \upsilon + 1 , J ----> 1 ] = \omega_{e} + 2(J + 1)Be](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/5739676a40923abeb2b84e533052c43d30622a3c)
![\tilde{\nu_{P}} [ \upsilon ----> \upsilon - 1 , J ----> 1 ] = \omega_{e} -2JBe](https://en.wikipedia.org/api/rest_v1/media/math/render/svg/e5bb8c5c0908cbcb867ab0cf507e37cd18f6b1a9)