Actividad metabólica de Rhizobium
Fernández Eraña Labná, Rueda Díaz Saúl, Trujillo Pineda Magalli.
Facultad de Ciencias, UNAM.
El suelo es un hábitat importante para una gran cantidad de organismos procariontes. Muchas de las bacterias que habitan en los suelos tienen un papel fundamental en la ecología de sus ecosistemas. De esta manera pueden agruparse según su papel ecológico en bacterias amonificadoras que descomponen sustancias orgánicas nitrogenadas y las transforman en amonio; bacterias nitrificadoras que oxidan el amoníaco hasta nitrato; bacterias fijadoras de nitrógeno que toman el nitrógeno atmosférico y lo transforman en compuestos aprovechables por los vegetales; bacterias celulolíticas que degradan celulosa (este es el grupo más numeroso); y bacterias pectinolíticas que degradan pectina.
Rhizobium
Rhizobium es un género de bacterias de la microbiota de plantas. Entre sus principales características se encuentra la simbiosis que forma con legumbres como alfalfa, frijol, lenteja, entre otros. Como muchas otras bacterias, Rhizobium posee la capacidad de fijar nitrógeno del medio (el nombre mismo proviene de esta función) y ayuda a mantener en equilibrio el N2 presente en la atmósfera. La interacción generada con la planta es bidireccional, la planta selecciona (parcialmente) los microorganismos y el microorganismo puede favorecer el crecimiento así como provocar enfermedades. Rhizobium debe de poder sobrevivir a las condiciones hostiles del suelo, para posteriormente colonizar las raíces y entrar a la planta. Una vez dentro, funge como fijadora de nitrógeno y se denomina bacteroide. La planta la provee de carbono y energía de ácidos dicarboxílicos, y los bacteroides le regresan amoniaco que usarán para síntesis de aminoácidos. Bajas concentraciones de oxígeno favorecen la fijación de N2, pues la nitrogenasa de estas bacterias es muy afín al oxígeno. Son quimioorganotróficas, oligotróficas y aerobias facultativas. Utilizan una gran variedad de carbohidratos y ácidos orgánicos. El crecimiento óptimo para R. giardini H152 se encuentra entre 6 y 7. No crece a pH 5 ni a pH 8. Por otro lado R. tropici CIAT899 puede crecer bajo condiciones de pH 4, 5 y hasta pH 8. R. tropici CIAT899 es una especie de Rhizobium que se encontraba clasificada anteriormente como Rhizobium leguminosarum. Está presente de forma natural en los suelos de América, Francia y en diferentes áreas de África. Por lo general, las estirpes de esta especie nodulan bien en suelos ácidos y parecen estar muy bien adaptadas a los suelos arenosos. Se distinguen dos tipos dentro de esta especie, A y B, que parecen ser divergentes pero presentan un plásmido simbiótico común. Rhizobium tropici CIAT899 es la estirpe de referencia dentro del tipo B por lo que ha sido muy estudiada. Debido a esto, se ha tomado como organismo modelo y está catalogada como una bacteria tolerante a distintos factores que representan estrés abiótico para ella. R. tropici CIAT899 tolera concentraciones de hasta 100 M de Al3+ y 200 M de Mn y puede crecer a pH 4,25, con elevadas concentraciones de NaCl y muy altas presiones osmóticas. Como mecanismo de osmoadaptación utilizados por el género Rhizobium destaca la regulación del pH citoplasmático.
Fluorescencia
La fluorescencia es la emisión de fotones por la transición electrónica de un estado excitado de singletes un estado de menor energía (estado basal). Es un tipo particular de luminiscencia que consiste en absorber longitudes de onda electromagnéticas y emitirlas con una longitud de onda distinta, siempre mayor, puesto que la energía emitida siempre es menor a la energía absorbida. Esta diferencia de energías se disipa en forma de calor. Las sustancias capaces de fluorescer se denominan fluoróforos. Espectroscopía de fluorescencia La espectroscopia es la rama de la física que se dedica al estudio de los diversos métodos de para la obtención de espectros, su medida y aplicaciones; su interpretación teórica en relación con la estructura atómica-molecular de la materia; y la relación de los estados energéticos de los átomos con las longitudes de onda que emiten.
Bioenergética celular
Las reacciones químicas que ocurren al interior de una célula están acompañadas por un cambio de energía. Todos estos cambios energéticos constituyen la bioenergética celular. Una forma de detectar la bioenergética de una célula es a través de la respuesta de enzimas y coenzimas que participan en el metabolismo. El NADH tiene como función principal el transporte de electrones de alta energía en las vías del metabolismo energético. En este proceso la molécula en su forma reducida (NADH) adquiere propiedades fluorescentes, lo que permite emplearla como indicador de la energética celular. La técnica de espectroscopía de fluorescencia permite obtener el espectro de emisión lumínica de una muestra fotosensible al ser excitada a una frecuencia específica. La actividad fluorescente depende de la concentración de la molécula, el solvente y de los procesos de desactivación fluorescente. A su vez, la concentración de la molécula depende de la cantidad de individuos en el cultivo y de la tasa de actividad metabólica de dichos organismos. El NADH absorbe fuertemente en el ultravioleta (350 nm) debido a la base adenina que posee. En solución tiene un pico de emisión a 460 nm y una vida útil de fluorescencia de 0,4 ns. La forma oxidada de la coenzima (NAD⁺) no fluoresce. El NADH es una coenzima reducida con un papel fundamental en la respiración aerobia. Es un importante donador de electrones para llevar a cabo la fosforilación oxidativa. La proporción de NAD+/NADH es un indicador clave que refleja el estado redox global de la célula. Esta proporción es fundamental para mantener la homeostasis redox celular. El NAD+/NADH citoplásmico depende de los niveles de oxígeno. Los nucleótidos de piridina son componentes importantes para la transformación energética y las reacciones de oxidorreducción dentro de la célula. Por lo tanto la proporción de NAD+/NADH es un indicador de las capacidades metabólicas de la célula. La proporción de NAD+/NADH se puede considerar generalmente como una lectura del metabolismo celular. Más de 700 enzimas oxidativas utilizan NAD+ o NADH como cofactores . Por lo tanto, un cambio en la proporción de NAD+/NADH puede indicar una alteración metabólica.
Lluvia ácida
Los componentes primarios de la lluvia ácida, es decir sus precursores, son agua de la humedad ambiental (H2O), óxidos de nitrógeno (NOx), dióxido de azufre (SO2) y trióxido de azufre (SO3). Los ácidos resultantes de la mezcla anterior que acidifican la humedad formando la lluvia ácida son ácido sulfúrico (H2SO4), ácido sulfuroso (H2SO3) y ácido nítrico (HNO3). La capa vegetal en descomposición y los volcanes en erupción liberan algunos químicos a la atmósfera que pueden originar lluvia ácida, pero la mayor parte de estas precipitaciones son el resultado de la acción humana. El mayor culpable de este fenómeno es la quema de combustibles fósiles procedentes de plantas de carbón generadoras de electricidad, las fábricas y los escapes de automóviles. Cuando el ser humano quema combustibles fósiles, libera dióxido de azufre (SO2) y óxidos de nitrógeno (NO) a la atmósfera. Estos gases químicos reaccionan con el agua, el oxígeno y otras sustancias para formar soluciones diluidas de ácido nítrico y sulfúrico. Los vientos propagan estas soluciones acídicas en la atmósfera a través de cientos de kilómetros. Cuando la lluvia ácida alcanza la Tierra, fluye a través de la superficie mezclada con el agua residual y entra en los acuíferos y suelos de cultivo. Los efectos de la lluvia ácida son la acidificación de las aguas terrestres, como ríos, lagos, mares y océanos, por tanto, daños graves en la vida acuática y en la terrestre, al no poder beber de estas aguas ni alimentarse de los peces y otros animales que habitan en ellas; causa daños importantes en la vegetación, en zonas forestales, selváticas, etcétera, de forma directa e indirecta; acaba con la vida de microorganismos fijadores de nitrógeno, es decir que reducen el nitrógeno ambiental; los ácidos que contienen sulfato en estas precipitaciones provocan un aumento del efecto invernadero; daña y deteriora la superficie de materiales, es decir tiene un efecto corrosivo sobre materiales como la madera, la piedra y el plástico, entre otros. El presente estudio tiene como objetivo observar el cambio de la actividad metabólica de las bacterias del suelo a través de la cuantificación de la coenzima NADH por espectroscopía de fluorescencia a variaciones en la acidez del medio.
Hipótesis
Al acidificar el cultivo bacteriano habrá una disminución de su actividad metabólica y por ello una disminución de la actividad fluorescente. Si se alcaliniza el cultivo bacteriano habrá un aumento inicial de actividad fluorescente hasta llegar a un máximo en el que habrá una disminución de su actividad metabólica.
Metodología
Se cultivaron Rhizobium giardinii H152 y Rhizobium tropici CIAT899 en medio LB (100 μL de stock en 15 mL de medio LB) y se dejaron incubar a 35ºC por 28 horas. Se prepararon 50 mL de medio YM y Rhizobium giardinii H152 y Rhizobium tropici CIAT899 fueron recultivadas (1 mL de cultivo en LB con 5 horas de incubación en 10 mL de medio YM) y se dejaron incubar a 35ºC por 23 horas. Muestras de 3 mL (Tabla 1) de estos cultivos fueron transferidas a cubetas de cuarzo para ser expuestas a radiación ultravioleta, longitud de onda de 355 nm, con un láser Nd-YAG que emite un haz de 1064 nm que se duplica (532 nm) y triplica (355 nm) en cinco periodos de 10s con descansos de 30s.
La radiación ultravioleta fue atenuada para alargar el tiempo de vida de los microorganismos con un filtro de densidad neutral 0.6 y enfocada con un lente cilíndrico. Se utilizó un filtro en la región de excitación y un filtro en la región de recepción para eliminar los remanentes del láser. Se obtuvieron los espectros de actividad fluorescente (una medición por segundo) con un espectrómetro en el rango visible con tiempo de adquisición breve (4o ms) e interfase a computadora. Se midió el pH de cada una de las muestras con un potenciómetro. Se realizaron pruebas estadísticas para observar diferencias entre los espectros obtenidos de cada una de las muestras.
Resultados
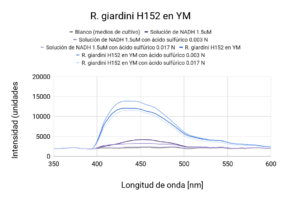
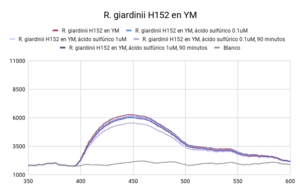
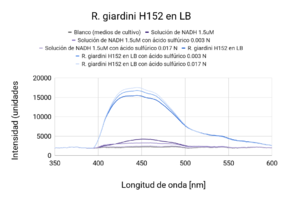
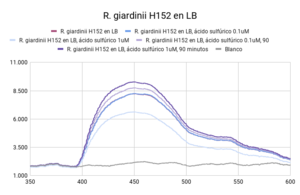
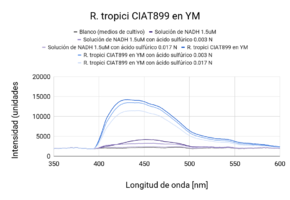
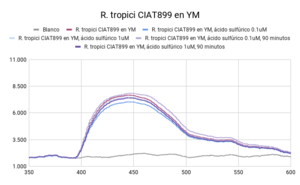
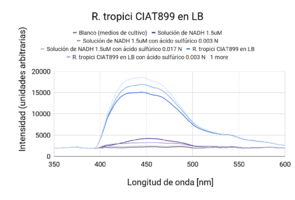
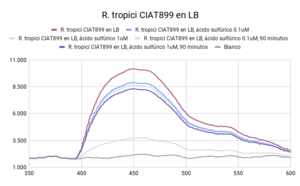
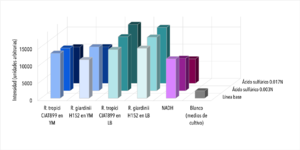
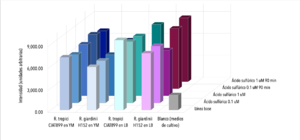
Se observaron comportamientos distintos en las cepas cultivadas en medio LB y en YM. Los cultivos en LB tuvieron un mejor crecimiento (posiblemente por la diferencia de tiempo de incubación), que se mostró en una mayor intensidad de actividad fluorescente en las líneas base (sin ácido). Por otro lado, las muestras con los tratamientos (con ácido sulfúrico 0.003 N y 0.017N) en cada uno de los medios respondió de manera distinta. En ambas cepas cultivadas en medio LB, la actividad fluorescente incrementó al disminuir el pH (a mayor concentración de ácido, mayor actividad fluorescente). En el caso de las cepas cultivadas en medio YM, R. tropici CIAT899 disminuyó su actividad fluorescente con ambos tratamientos(con ácido sulfúrico 0.003 N y 0.017N), sin embargo R. giardini H152 mostró un aumento de actividad fluorescente con el primer tratamiento (con ácido sulfúrico 0.003 N) y una disminución, incluso por debajo de la línea base (solo el cultivo), con el segundo tratamiento (con ácido sulfúrico 0.017N). Entre las muestras de NADH con ácido sulfúrico 0.017 N y blanco no existen diferencias significativas. Entre las muestras de R. tropici CIAT899 en medio LB y R. giardini H152 en medio LB no existen diferencias significativas. Entre las muestras de R. tropici CIAT899 en medio LB con ácido sulfúrico 0.003 N y R. giardini H152 en medio LB con ácido sulfúrico 0.003 N no existen diferencias significativas. Entre las muestras de R. tropici CIAT899 en medio YM y R. giardini H152 en medio YM con ácido sulfúrico 0.003 N no existen diferencias significativas. Entre las muestras de R. tropici CIAT899 en medio YM con 0.1 mL de ácido sulfúrico 0.5%m/v y R. giardini H152 en medio YM con ácido sulfúrico 0.003 N no existen diferencias significativas. La actividad fluorescente de R. tropici CIAT899 en LB tiende a bajar al aumentar la concentración de ácido. Después de 90 minutos, la intensidad es menor. La actividad fluorescente de R. giardinii H152 en LB se mantiene constante con la primera concentración de ácido y baja con la segunda. Después de 90 minutos la intensidad aumenta, siendo el pico máximo la muestra con ácido 1 uM. En R. tropici CIAT899 en YM hay una disminución de actividad fluorescente al agregar ácido, siendo esta más pronunciada en la concentración 0.1 uM. Después de 90 minutos la intensidad aumenta con respecto a las primeras mediciones con ácido, con un pico máximo en la muestra con ácido 0.1 uM. La actividad fluorescente de R. giardinii H152 en YM tiende a bajar al aumentar la concentración de ácido. Después de 90 minutos la intensidad es aún menor, siendo el espectro de menor intensidad YM 32 con ácido 0.1 uM después del reposo. La intensidad de actividad fluorescente más alta fue de LB 24 en línea base (alrededor de 10000 cuentas) y la más baja fue LB 24 con ácido 0.1 uM después de 90 minutos (alrededor de 3700 cuentas).
Discusión
Al aumentar las 3 concentraciones distintas de ácido al NADH en solución, su intensidad fluorescente decayó en cada una de las exposiciones a radiación UV. Retomando la Figura 5, se puede observar que la mayor cantidad de intensidad fluorescente se observó en las bacterias cuyo medio de cultivo era LB. Siendo estas mayores que las bacterias en el medio YM. Inicialmente, se esperaba que hubiera una mayor fluorescencia en los medios YM debido a que según investigaciones pasadas, Rhizobium tenía una mayor proliferación ya que el medio de cultivo con levadura manitol representaba un ambiente de crecimiento más óptimo [1]. Las 2 distintas cepas tuvieron una variación en su fluorescencia ligada a las distintas concentraciones de ácido a las que se sometieron. Sin embargo, en el medio LB, ambas cepas aumentaron la intensidad fluorescente conforme aumentaba la concentración Normal de ácido sulfúrico en el ambiente. Una explicación para esto reside en que ciertas cepas de Rhizobium tienen capacidad de resistir concentraciones de pH bajas ya cuenta con muy buenos mecanismos de respuesta a estrés de distintos tipos, incluyendo regulación de pH [2]. Sin embargo esto no ignora el hecho de que Rhizobium son bacterias neutrófilas. Según la literatura consultada, el crecimiento óptimo para R. giardini H152 se encuentra entre 6 y 7. Por otro lado R. tropici CIAT899 puede crecer bajo condiciones de pH 4, 5 y hasta pH 8 [3]. Sin embargo, R. tropici ha presentado una gran tolerancia a ambientes ácidos, bajo estas concentraciones todavía presenta un crecimiento poblacional latente pero lento. El mecanismo mediante el cual organismos neutrófilos regula el pH citoplasmático se trata de mantener entre 7.5 y 8 contra un pH menor en el exterior. Esto se logra mediante la expulsión de protones [4]. Las bacterias utilizan el gradiente de protones que se genera al momento de sintetizar ATP. Al hacer esto se deja de oxidar NADH, provocando que éste se acumule en el citoplasma. Mientras tanto, el NADH se sigue produciendo debido a que el metabolismo sigue activo a pesar de que se encuentra en un ambiente ácido.
Conclusiones
Los resultados arrojaron información que se complementa en parte con la teoría consultada. La actividad metabólica aumentó en presencia de un ambiente ácido, lo cual en primera instancia parecería contradictorio porque se trata de organismos que sufren de estrés bajo estas condiciones. Sin embargo, tiene sentido porque en pH bajos, es el crecimiento poblacional el que se ve afectado, no su actividad metabólica, la cual resultó en un incremento de su actividad fluorescente. La intensidad fluorescente de ambas cepas varía en cuanto a concentraciones de acidez y a los dos medios en los que fueron cultivadas. En medio LB, todas las mediciones presentaron mayor intensidad fluorescente en comparación a cualquier otra con medio YM. Los resultados de la actividad fluorescente respondiendo a las dos concentraciones de ácido pueden deberse al lapso entre adición del ácido y exposición a radiación uv, ya que fue muy poco. Se tomará en cuenta para futuros experimentos. Al dejar de oxidar NADH debido a la utilización del gradiente de protones para sintetizar ATP, éste se acumula en la célula debido a que el metabolismo sigue andando a pesar de que se encuentre en un ambiente ácido; debido a esto, observamos el aumento en la intensidad fluorescente.
Agradecimientos
Le agradecemos a la Maestra Ana Paulina Mendoza por dirigir este proyecto.
Le agradecemos a Lucrecia Lombardi, estudiante de física de la UAM-I por apoyarnos tanto en la parte experimental como en la discusión de los resultados. Le agradecemos al Doctor Manuel Fernández, investigador responsable del laboratorio de Óptica Cuántica (UAM-I) por permitirnos el uso del laboratorio y apoyarnos tanto en la parte experimental como en la discusión de los resultados. Le agradecemos a Carlos García, laboratorista responsable del laboratorio de Óptica Cuántica (UAM-I) por apoyarnos en la parte experimental del proyecto.
Le agradecemos a la Doctora Laura Espinoza, del laboratorio de Evolución Molecular y Experimental (Instituto de Ecología, UNAM), por otorgarnos los cultivos de Rhizobium giardinii H152 y Rhizobium tropici CIAT899. Le agradecemos a la Doctora María Elena Flores, del departamento de Biología Molecular y Biotecnología (Instituto de Investigaciones Biomédicas, UNAM) por otorgarnos la solución patrón de NADH. Le agradecemos a la Doctora Ángeles Cancino, responsable del Taller de Biología Molecular I y II por el apoyo con el préstamo de instalaciones y material para realizar la preparación de medios de cultivo e incubación de cepas. Le agradecemos al Laboratorio de Biología de Procariontes (Facultad de Ciencias, UNAM), por permitirnos el uso del material e instalaciones para la realización de los cultivos. Le agradecemos al Doctor Rafael Godínez por apoyarnos en la discusión de los resultados.
Referencias
Andersen, K.B., y K. Von Meyenburg. 1977. Charges of nicotinamide adenine nucleotides and adenylate energy charge as regulatory parameters of the metabolism in Escherichia coli. The Journal of Biological Chemistry. Vol. 252(12): 4151-6.
Bender, K., Buckley, D., Madigan, M., Martinko, J., Stahl, D. 2015. Brock. Biología de los microorganismos. Pearson Educación. España. 14 edición. P. p. 88, 89.
Bilan, D. S., Matlashovab, M., Gorokhovsky, A. Y., Schultz, C., Enikolopov, G., Belousov, V. V. 2014. Genetically encoded fluorescent indicator for imaging NAD+/NADH ratio changes in different cellular compartment. Biochimica et Biophysica Acta (BBA) – General subjects 1840(3): 951-957.
Bravo-Álvarez, H. Soto-Ayala, R., Sosa-Echeverría, R., Sánchez-Álvarez, P. 2003. Efecto de la lluvia ácida en el material constituyente de los monumentos mayas mexicanos. Ingeniería Investigación y Tecnología. Vol. 4: 195-205.
Castillo, C., Rosa, H., 2008. Interacción Rhizobium Leguminosarum Bv Trifolii Y Hongos Micorrícicos En Un Andisol Con Diferentes Niveles De Saturación De Aluminio. Idesia. Vol. 26(3): 7-19.
Clark, D., Buckley, D., Madigan, M., Martinko, J., Stahl, D. 2011. Brock. Biology of microorganisms. Pearson Education. USA. 13 edición. P. p. 92, 93, 98, 144, 145, 529, 531.
Douglas A., Burns, J., Daid A., Gay, C., Lehmann, M. B. 2016. Acid rain and its environmental effects: Recent scientific advances. Elsevier Atmospheric Environment. Vol. 146: 1-4.
Garcés-Giraldo, L. F. y M. L. Hernández-Ángel. 2016. La lluvia ácida: un fenómeno fisicoquímico de ocurrencia local. Revista Lasallista de Investigación. Vol. 1: 67-72.
Herrera, L. y M. Ugia. 1999. Lluvia ácida, aspectos fisicoquímicos y ambientales. Instituto de Estudios Ambientales, Palmira, Colombia. P129.
Kasimova, M. R., Grigiene, J., Krab, K., Hagedorn, P. H., Flyvbjerg, H., Andersen, P. E., Møllere, I. M. 2006. The Free NADH Concentration Is Kept Constant in Plant Mitochondria under Different Metabolic Conditions. The Plant Cell. Vol. 18: 688–698.
Lombardi, L. 2018. Medición del efecto del estrés oxidativo sobre el metabolismo energético en neuroblastos mediante espectroscopia de fluorescencia. Universidad Autónoma Metropolitana Unidad Iztapalapa. Ciencias Básicas e Ingeniería. Departamento de Física.
Poole, P., Ramachandran, V., Terpolilli, J. (2018). Rhizobia: from saprophytes to endosymbionts. Nature Reviews Microbiology, 16(5) 291–303.
Sun, F., Dai, C., Xie, J., Hu, X. 2012. Biochemical Issues in Estimation of Cytosolic Free NAD/NADH Ratio. PLOS ONE 7(5): e34525.
Wos, M. L., Pollard, P. C. 2009. Cellular nicotinamide adenine dinucleotide (NADH) as an indicator of bacterial metabolic activity dynamics in activated sludge. Water Science & Technology. Vol. 60 (3): 783-791.
Yu, Q. y A. A. Heikal. 2009. Two photon autofluorescence dynamics imaging reveals sensitivity of intracellular NADH concentration and conformation to cell physiology at the single-cell level. Journal of Photochemistry and Photobiology B: Biology. Vol. 95: 46-57.
- ↑ López-Alcocer J.J, Lépiz-Ildefonso R., González-Eguiarte D.. (2017). CARACTERIZACIÓN MORFOLÓGICA Y BIOQUÍMICA DE CEPAS DE Rhizobium COLECTADAS EN FRIJOL COMÚN SILVESTRE Y DOMESTICADO . Rev. Fitotec. Mex, 40(1), 73 - 81.
- ↑ . Elección y caracterización de mutantes de Rhizobium tropici CIAT899 afectados en la producción de factores nod en condiciones de estrés salino. Tesis doctoral. Departamento De Microbiología. Facultad De Biología. Universidad de Sevilla. P.p. 43-48.
- ↑ Díaz, C. 2010. Aislamiento, caracterización y selección de rhizobia autóctonos que nodulan habichuela roja (Phaseolus vulgaris L.) en la República Dominicana. Universidad de León Departamento de Ingeniería y Ciencias Agrarias. Instituto de Medio Ambiente, Recursos Naturales y Biodiversidad. P.p. 78-79.
- ↑ Graham P.H. (1991). Stress tolerance in Rhizobium and Bradyrhizobium, and nodulation under adverse soil conditions . MICROBIOL, 32, 475-484.